Norme per l'attuazione delle direttive della Comunità economica europea sulla produzione e la vendita dei cosmetici.
| Settore: | Normativa nazionale |
| Materia: | 4. Alimenti e bevande |
| Capitolo: | 4.10 sostanze non alimentari |
| Data: | 11/10/1986 |
| Numero: | 713 |
| Sommario |
| Art. 1. |
| Art. 2. |
| Art. 2 bis. [8] |
| Art. 2 ter. [10] |
| Art. 3. |
| Art. 4. |
| Art. 5. |
| Art. 6. |
| Art. 7. |
| Art. 8. [16] |
| Art. 8 bis. [24] |
| Art. 9. |
| Art. 10. |
| Art. 10 bis. [35] |
| Art. 10 ter. [36] |
| Art. 11. |
| Art. 12. |
| Art. 13. |
| Art. 14. |
| Art. 15. |
| Art. 16. |
| Art. 17. |
§ 4.10.17 - Legge 11 ottobre 1986, n. 713. [1]
Norme per l'attuazione delle direttive della Comunità economica europea sulla produzione e la vendita dei cosmetici.
(G.U. 30 ottobre 1986, n. 253, S.O.)
1. Ai fini della presente legge si intendono per prodotti cosmetici le sostanze e le preparazioni, diverse dai medicinali, destinate ad essere applicate sulle superfici esterne del corpo umano (epidermide, sistema pilifero e capelli, unghie, labbra, organi genitali esterni) oppure sui denti e sulle mucose della bocca allo scopo, esclusivo o prevalente, di pulirli, profumarli, modificarne l'aspetto, correggere gli odori corporei, proteggerli o mantenerli in buono stato. [2]
2. I prodotti cosmetici non hanno finalità terapeutica e non possono vantare attività terapeutiche.
3. Sono in particolare prodotti cosmetici, ai sensi dei commi precedenti, i prodotti che figurano nell'allegato I annesso alla presente legge.
1. Le sostanze indicate nell'allegato II non possono essere presenti nella composizione dei cosmetici.
2. La presenza di tracce delle sostanze elencate nell'allegato II è tuttavia tollerata a condizione che essa sia tecnicamente inevitabile, nonostante l'osservanza di procedimenti corretti di fabbricazione e purchè sia conforme alle disposizioni di cui al comma 1 dell'art. 7.
3. L'impiego delle sostanze e dei coloranti indicati negli allegati III e IV è consentito con le limitazioni di dosi, le condizioni, il campo di impiego e di applicazione riportati negli stessi allegati.
4. E' vietato l'uso di coloranti diversi da quelli indicati nell'allegato IV. [3]
5. Nei prodotti appartenenti alle categorie di cui alle diverse sezioni dell'allegato V, non possono essere presenti sostanze che non siano espressamente previste in detto allegato o per le quali non siano rispettati i limiti e le condizioni ivi prescritti.
5 bis. [E' vietato l'uso nei cosmetici di ingredienti o di combinazioni di ingredienti sperimentati su animali a partire dal 1°gennaio 1998] [4] [5].
5 ter. [Il Ministro della sanità, con proprio decreto, adegua il termine di cui al comma 5 bis, a quello eventualmente stabilito dalla Comunità europea secondo quanto previsto dalla
6. Gli elenchi e le prescrizioni di cui agli allegati sono aggiornati, tenuto conto anche delle direttive della Comunità economica europea, con decreto del Ministro della sanità, di concerto con il Ministro dell'industria, del commercio e dell'artigianato.
7. Con le stesse modalità possono essere aggiunti, in apposite sezioni dell'allegato V, altri elenchi comprendenti le sole sostanze utilizzabili in determinate categorie di prodotti cosmetici.
8. I decreti di cui ai commi 6 e 7, salvo i provvedimenti urgenti a tutela della salute pubblica, prevedono i termini entro i quali i produttori e gli importatori si debbono adeguare alle prescrizioni.
9. Quando i decreti di aggiornamento degli allegati comportano l'utilizzazione di sostanze non comprese fra quelle consentite dalle direttive della Comunità economica europea, i decreti stessi devono indicare il periodo, non superiore a tre anni, per il quale viene autorizzato l'impiego di dette sostanze, specificare i prodotti cosmetici per la cui produzione l'impiego viene ammesso e imporre l'adozione di diciture o di simboli idonei a contraddistinguere chiaramente le relative confezioni.
10. Il Ministro della sanità trasmette annualmente al Parlamento una relazione sullo stato di attuazione della legge nonchè sugli aggiornamenti di cui ai commi precedenti.
10 bis. Ai fini della comunicazione annuale alla Commissione europea dei dati sulle sperimentazioni su animali, il Ministro della sanità applica la procedura di cui all'articolo 16, comma 2, del
1. Fatti salvi gli obblighi generali ai sensi dell'articolo 7, è vietata:
a) l'immissione sul mercato dei prodotti cosmetici la cui formulazione finale sia stata oggetto, allo scopo di conformarsi alle disposizioni della presente legge, di una sperimentazione animale con un metodo diverso da un metodo alternativo dopo che un tale metodo alternativo sia stato convalidato e adottato a livello comunitario, tenendo debitamente conto dello sviluppo della convalida in seno all'OCSE;
b) l'immissione sul mercato dei prodotti cosmetici contenenti ingredienti o combinazioni di ingredienti che siano stati oggetto, allo scopo di conformarsi alle disposizioni della presente legge, di una sperimentazione animale con un metodo diverso da un metodo alternativo dopo che un tale metodo alternativo sia stato convalidato e adottato a livello comunitario, tenendo debitamente conto dello sviluppo della convalida in seno all'OCSE;
c) la realizzazione di sperimentazioni animali relative a prodotti cosmetici finiti, allo scopo di conformarsi alle disposizioni della presente legge;
d) la realizzazione, sul territorio, di sperimentazione animali relative a ingredienti o combinazioni di ingredienti allo scopo di conformarsi alle disposizioni della presente legge, dalla data in cui dette sperimentazioni vanno sostituite da uno o più metodi alternativi convalidati che figurano nel
2. I divieti di cui al comma 1, lettere a), b) e d), decorrono dalle date indicate in appositi decreti del Ministro della salute, di concerto con il Ministro delle attività produttive, adottati in modo da consentire il rispetto dei calendari stabiliti dalla Commissione europea, in attuazione dell'articolo 1, paragrafo 2), della
3. In circostanze eccezionali, qualora sorgano gravi preoccupazioni riguardo alla sicurezza di un ingrediente cosmetico esistente il Ministero della salute può chiedere alla Commissione europea di accordare una deroga alle disposizioni di cui ai commi 1 e 2, se:
a) l'ingrediente è ampiamente utilizzato e non può essere sostituito con un altro ingrediente atto a svolgere una funzione analoga;
b) il problema specifico riguardante la salute umana è dimostrato e la necessità di effettuare esperimenti sugli animali è giustificata e supportata da un protocollo di ricerca dettagliato proposto come base per la valutazione.
4. Ai fini del presente articolo si intende per:
a) prodotto cosmetico finito: il prodotto cosmetico nella sua formulazione finale quale immesso sul mercato a disposizione del consumatore finale, ovvero il suo prototipo;
b) prototipo: il primo modello o progetto che non è stato prodotto in lotti e dal quale è stato copiato o sviluppato il prodotto cosmetico finito.
1. E' vietato l'utilizzo, nei prodotti cosmetici, di sostanze classificate come cancerogene, mutagene sulle cellule germinali o tossiche per la riproduzione, di categoria 1A, 1B e 2, ai sensi dell'allegato VI, parte 3, del
2. Chi viola le disposizioni del comma 1 soggiace alle sanzioni previste dall'articolo 7, comma 5.
1. Salvo che i fatti non costituiscano i più gravi reati previsti dai commi 5 e 6 dell'art. 7, chiunque impiega nella preparazione dei cosmetici sostanze indicate nell'allegato II è punito con la reclusione da sei mesi a due anni e con la multa da lire 2.000.000 a lire 15.000.000 o, se il fatto è commesso per colpa, con l'arresto da tre mesi ad un anno o con l'ammenda da lire 1.000.000 a lire 10.000.000. Alle stesse pene, ridotte di un terzo, è soggetto chi impiega nella preparazione di cosmetici coloranti non compresi negli allegati III e IV o sostanze conservanti non comprese nell'allegato V - sezione 1, o filtri U.V. non compresi nell'allegato V - sezione 2, o sostanze non comprese in altre liste positive aggiunte in apposite sezioni dello stesso allegato V, ai sensi del comma 7 dell'art. 2.
2. Chiunque impiega nella preparazione di cosmetici sostanze e coloranti inclusi negli allegati III e IV senza osservare le limitazioni e le condizioni negli stessi precisati è punito con la reclusione da un mese ad un anno e con la multa da lire 500.000 a lire 5.000.000 o, se il fatto è commesso per colpa, con l'arresto fino a sei mesi o con l'ammenda da lire 250.000 a lire 2.500.000.
3. Alle pene previste nel comma 2 è soggetto, altresì:
a) chiunque impieghi nella preparazione di cosmetici sostanze comprese nell'allegato V, sezioni prima e seconda, o in altre liste positive aggiunte in apposite sezioni dello stesso allegato ai sensi del comma 7 dell'articolo 2, senza osservare i limiti e le condizioni precisate nel medesimo allegato o nei decreti ministeriali previsti nel medesimo articolo 2;
b) chiunque contravviene alle disposizioni di cui all'articolo 2-bis, commi 1 e 2. [12]
3 bis. In caso di reiterazione la licenza di produzione e di commercio nel settore è sospesa per un periodo di tre mesi. [13]
4. In caso di prodotti fabbricati all'estero, le pene previste nei commi precedenti si applicano all'importatore.
1. I prodotti disciplinati dalla presente legge non possono essere registrati come presidi medico-chirurgici, ai sensi dell'art. 189 del testo unico delle leggi sanitarie approvato con
2. Entro un anno dalla data di entrata in vigore della presente legge, il Ministero della sanità procede alla revisione di tutti i provvedimenti con cui i prodotti destinati ad essere applicati sulle superfici esterne del corpo umano, oppure sui denti e sulle mucose della bocca, sono stati registrati come presidi medico-chirurgici, provvedendo, a seconda dei casi, a:
a) revocare la registrazione dei prodotti di cui alla presente legge, nonchè stabilire il termine, non superiore a dodici mesi, entro il quale dovranno essere ritirate dal commercio le formazioni a suo tempo autorizzate;
b) confermare la registrazione dei prodotti diversi dai cosmetici aventi soltanto finalità disinfettante, disinfestante o insettorepellente;
c) eliminare dalle confezioni, dagli stampati e dalla pubblicità dei prodotti di cui conferma la registrazione le affermazioni che possono indurre un uso cosmetico dei prodotti o che comunque attribuiscono alle miscele finalità proprie dei prodotti cosmetici.
3. Quando, ai sensi del comma 2, revoca la registrazione di un prodotto, il Ministro della sanità provvede, contemporaneamente, alla revoca di qualsiasi licenza di pubblicità sanitaria relativa allo stesso. In caso di conferma della registrazione, i messaggi pubblicitari eventualmente autorizzati devono essere adeguati alle effettive caratteristiche del prodotto.
4. Trascorso un anno dalla data di entrata in vigore della presente legge decadono le autorizzazioni per la produzione e il commercio dei prodotti destinati ad essere applicati sulle superfici esterne del corpo umano, oppure sui denti e sulle mucose della bocca, registrati come presidi medico-chirurgici, rilasciate anteriormente alla data di entrata in vigore della legge medesima. Il Ministro della sanità, con proprio decreto, stabilisce il termine, non superiore a dodici mesi, entro il quale dovranno essere ritirate dal commercio le confezioni a suo tempo autorizzate.
1. Entro sei mesi dalla data di entrata in vigore della presente legge, le imprese produttrici e importatrici, anche attraverso le loro associazioni, devono comunicare al Ministero della sanità gli elenchi delle sostanze e dei prodotti impiegati nella preparazione dei cosmetici.
1. L'istituto superiore di sanità svolge, nella materia oggetto della presente legge, funzioni di consulenza della competente amministrazione statale. In tale ambito, l'Istituto, oltre ad esprimere parere sugli elenchi di cui all'art. 5:
a) fornisce valutazioni tecniche per l'adozione dei provvedimenti di cui al comma 2 dell'art. 7;
b) propone al Ministro della sanità eventuali aggiornamenti straordinari degli elenchi, degli adempimenti e delle modalità previsti dagli articoli 2 e 4.
2. I criteri di massima in ordine all'idoneità per i locali e le attrezzature delle officine di produzione dei cosmetici di cui all'art. 10 vengono stabiliti dall'Istituto superiore per la prevenzione e la sicurezza del lavoro.
1. I prodotti cosmetici devono essere fabbricati, manipolati, confezionati e venduti in modo tale da non causare danni alla salute umana se applicati nelle normali o ragionevolmente prevedibili condizioni d'uso, tenuto conto in particolare della presentazione del prodotto, dell'etichettatura, delle eventuali istruzioni per l'uso e l'eliminazione, nonché di qualsiasi altra indicazione o informazione da parte del produttore o del suo mandatario o di ogni altro responsabile della commercializzazione di questi prodotti sul mercato comunitario. La presenza delle indicazioni o delle avvertenze di cui al presente comma non dispensa i responsabili dal rispetto di tutti gli altri obblighi stabiliti dalla presente legge. [14]
2. Il Ministro della sanità, tenendo conto delle direttive comunitarie, determina, con proprio decreto, i metodi di analisi necessari per controllare la composizione dei prodotti cosmetici ed altresì i criteri di purezza batteriologica e chimica e relativi metodi di controllo, nonchè, se del caso, particolari prescrizioni per la conservazione.
3. Con lo stesso decreto vengono altresì determinate le modalità da seguire per il prelievo di campioni di cui al successivo art. 11.
4. Con corrispondenti decreti si provvede ai successivi aggiornamenti.
5. Chiunque produce, detiene per il commercio o pone in commercio prodotti cosmetici che, nelle normali o ragionevolmente prevedibili condizioni d'uso, possono essere dannosi per la salute è punito con la reclusione da 1 a 5 anni e con la multa non inferiore a lire 2.000.000. [15]
6. Se il fatto è commesso per colpa, si applicano le pene previste dal comma 5 ridotte da un terzo a un sesto.
7. Chiunque contravviene ai criteri di purezza batteriologica e chimica dei prodotti cosmetici soggiace alla sanzione amministrativa da lire 500.000 a lire 5.000.000.
1. I prodotti cosmetici, ivi compresi i campioni gratuiti distribuiti al di fuori dei normali punti di vendita, possono essere immessi sul mercato soltanto se il contenitore a diretto contatto con il prodotto, di seguito indicato come condizionamento primario, e l'imballaggio secondario recano, oltre alle eventuali denominazioni di fantasia, le seguenti indicazioni in caratteri indelebili ed in modo facilmente leggibile e visibile:
a) il nome o la ragione sociale e la sede legale del produttore o del responsabile dell'immissione sul mercato del prodotto cosmetico stabilito all'interno dell'Unione europea. Tali indicazioni possono essere abbreviate purché sia possibile l'identificazione dell'impresa;
b) il contenuto nominale al momento del confezionamento, espresso in misure legali del sistema metrico, per prodotti aventi peso o volume netto superiore o uguale, rispettivamente, a 5 grammi o 5 millilitri. L'indicazione non è obbligatoria per i campioni gratuiti, per le monodosi, nonché per gli imballaggi preconfenzionati solitamente commercializzati per insieme di pezzi, per i quali l'indicazione del peso e del volume non ha rilevanza pratica; in quest'ultimo caso sull'imballaggio deve essere menzionato il numero dei pezzi, quando lo stesso non possa essere agevolmente determinato dall'esterno. In aggiunta alle indicazioni in misure legali del sistema metrico, il contenuto nominale può essere espresso anche in unità di misura diverse, purché con caratteri di dimensioni non superiori a quelle delle misure legali;
c) la data di durata minima del prodotto cosmetico, che corrisponde a quella alla quale tale prodotto, opportunamente conservato, continua a soddisfare la sua funzione iniziale e rimane in particolare conforme alle disposizioni di cui al comma 1 dell'articolo 7. Essa è indicata con la dicitura "da usare preferibilmente entro ..." seguita dalla data stessa, oppure dall'indicazione del punto della confezione su cui questa figura. La data è indicata in modo chiaro e si compone, nell'ordine, del mese e dell'anno oppure del giorno, del mese e dell'anno. Se necessario, tale indicazione è completata precisando anche le condizioni da rispettare per garantire la durata indicata. L'indicazione della data di durata minima non è obbligatoria per i prodotti cosmetici che abbiano una durata minima superiore ai trenta mesi. Per tali prodotti è riportata un'indicazione relativa al periodo di tempo in cui il prodotto, una volta aperto, può essere utilizzato senza effetti nocivi per il consumatore. Tale informazione è indicata tramite il simbolo raffigurato nell'allegato VI-bis, seguito dall'indicazione del numero dei mesi, o degli anni, o degli anni e dei mesi, in cui il prodotto, una volta aperto, può essere utilizzato senza effetti nocivi per il consumatore [17];
d) le precauzioni particolari per l'impiego, segnatamente quelle indicate nelle colonne degli allegati III e V intitolate "Modalità di impiego e avvertenze da indicare obbligatoriamente sull'etichetta", le quali debbono figurare sul condizionamento primario e sull'imballaggio secondario nonché le eventuali indicazioni concernenti precauzioni particolari da osservare per i prodotti cosmetici di uso professionale, in particolare quelli destinati ai parrucchieri. In caso di impossibilità pratica, un foglio di istruzioni, una fascetta o un cartellino allegati devono riportare tali indicazioni, alle quali il consumatore deve essere rinviato mediante un'indicazione abbreviata o mediante il simbolo raffigurato nell'allegato VI, che devono comparire sul condizionamento primario e sull'imballaggio secondario;
e) il numero del lotto di fabbricazione o il riferimento che consenta la identificazione della fabbricazione; tuttavia, in caso di impossibilità pratica dovuta alle ridotte dimensioni del prodotto cosmetico, tale menzione può figurare soltanto sull'imballaggio secondario di detti prodotti;
f) il Paese d'origine per i prodotti fabbricati in Paesi non membri dell'Unione europea;
g) la funzione del prodotto, salvo se risulta dalla presentazione dello stesso;
h) l'elenco degli ingredienti nell'ordine decrescente di peso al momento dell'incorporazione. Tale elenco viene preceduto dal termine "ingredienti" o "ingredients". In caso di impossibilità pratica, un foglio di istruzioni, un'etichetta, una fascetta o un cartellino allegato devono riportare gli ingredienti, ai quali il consumatore deve essere rinviato mediante un'indicazione abbreviata o mediante il simbolo di cui all'allegato VI, che devono comparire sulla confezione. Tuttavia, non sono considerati ingredienti:
1) le impurezze contenute nelle materie prime utilizzate;
2) le sostanze tecniche secondarie utilizzate nella fabbricazione ma che non compaiono nella composizione del prodotto finito;
3) le sostanze utilizzate nei quantitativi strettamente necessari come solventi o come vettori di composti odoranti e aromatizzanti [18].
2. I composti odoranti e aromatizzanti e le loro materie prime devono essere indicati con il termine "profumo" o "parfum" e "aroma".
Tuttavia, la presenza di sostanze la cui indicazione è prescritta ai sensi della colonna "Altre limitazioni e prescrizioni" dell'allegato III figurano nell'elenco indipendentemente dalla funzione che hanno nel prodotto [19].
3. Gli ingredienti in concentrazione inferiore all'1 per cento possono essere menzionati in ordine sparso dopo quelli in concentrazione superiore all'1 per cento [20].
4. I coloranti possono essere indicati in ordine sparso dopo gli altri ingredienti, conformemente al numero colour index o alla denominazione di cui all'allegato IV. Per i prodotti cosmetici da trucco, ivi compresi quelli per le unghie e per i capelli, immessi sul mercato in varie sfumature di colore, può essere menzionato l'insieme dei coloranti utilizzati nella gamma a condizione di aggiungervi le parole "può contenere" o il simbolo "+/-" [21].
5. Gli ingredienti devono essere dichiarati con la nomenclatura comune prevista dall'inventario europeo degli ingredienti cosmetici di cui alla decisione della Commissione delle Comunità europee 96/335/CE, dell'8 maggio 1996, pubblicata nella Gazzetta Ufficiale delle Comunità europee n. 132 del 1° giugno 1996, e sue modificazioni, ovvero, se gli ingredienti non sono compresi in tale inventario, con una delle altre denominazioni previste dal predetto inventario [22].
6. Qualora, a causa delle dimensioni o della forma, sia impossibile far figurare le indicazioni di cui alle lettere d) ed h) del comma 1 su un foglio di istruzioni allegato, dette indicazioni devono figurare su una fascetta o un cartellino fissati al prodotto cosmetico.
7. Qualora, nel caso del sapone e delle perle da bagno, o a causa delle dimensioni o della forma del prodotto, sia impossibile far figurare le indicazioni di cui alla lettera h) del comma 1 su una fascetta o un cartellino fissati sul prodotto, oppure su un foglio di istruzioni allegato, dette indicazioni devono figurare su un avviso collocato in prossimità del contenitore nel quale il prodotto cosmetico è esposto per la vendita.
8. Per i cosmetici confezionati dal venditore su richiesta dell'acquirente o preconfezionati in vista della loro vendita immediata, sempre nel rispetto delle disposizioni di cui all'articolo 10, le diciture di cui ai commi 1, 2, 3 e 4 devono essere riportate almeno sull'imballaggio secondario, a cura del venditore.
9. I cosmetici posti in vendita allo stato sfuso devono essere venduti unitamente ad un foglio riportante le indicazioni di cui ai commi 1, 2, 3 e 4.
9-bis. Il fabbricante o il responsabile dell'immissione del prodotto cosmetico sul mercato comunitario può indicare, sulla confezione del prodotto o su qualsiasi documento, foglio di istruzioni, etichetta, fascetta o cartellino che accompagna o si riferisce a tale prodotto, che quest'ultimo è stato sviluppato senza fare ricorso alla sperimentazione animale, solo a condizione che il fabbricante e i suoi fornitori non abbiano effettuato o commissionato sperimentazioni animali sul prodotto finito, sul suo prototipo, nè su alcun suo ingrediente e che non abbiano usato ingredienti sottoposti da terzi a sperimentazioni animali al fine di ottenere nuovi prodotti cosmetici [23].
10. Sul condizionamento primario e sull'imballaggio secondario dei prodotti cosmetici è consentito l'uso di espressioni che facciano riferimento ad acque minerali, a sorgenti o fanghi termali, soltanto se i prodotti stessi contengono sali minerali o fango maturato in acqua termale o fitoestratti da vegetazione termale, provenienti dagli stabilimenti termali di cui all'articolo 14, lettera a), del
11. Ai prodotti cosmetici non si applicano le disposizioni di cui agli articoli 5e7 della
12. I prodotti cosmetici non sono altresì assoggettati alle norme di cui alla
13. Le indicazioni di cui alle lettere b), c), d) e g) del comma 1 devono essere redatte in lingua italiana.
14. Le indicazioni di cui alla lettera h) del comma 1 possono essere riportate anche solo sull'imballaggio secondario del prodotto.
15. Chiunque contravviene alle disposizioni del presente articolo soggiace alla sanzione amministrativa da lire cinquecentomila a lire quattromilioni.
1. Il produttore o il suo mandatario o il soggetto per conto del quale è fabbricato un prodotto cosmetico, o il responsabile dell'immissione sul mercato comunitario di un prodotto cosmetico importato che, per motivi di riservatezza commerciale, intende ottenere la non iscrizione di uno o più ingredienti di un prodotto cosmetico nell'elenco di cui all'articolo 8, comma 1, lettera h), presenta a tal fine una domanda presso il Ministero della sanità - Dipartimento per la valutazione dei medicinali e la farmacovigilanza, d'ora in avanti indicato come "Ministero".
2. La domanda di cui al comma 1 deve contenere:
a) il nome o la ragione sociale e l'indirizzo o la sede legale del richiedente;
b) una precisa identificazione degli ingredienti per i quali è richiesta la riservatezza, tramite:
1) i numeri CAS (Chemical Abstracts Service), EINECS (European Inventory of Existing Commercial Chemical Substances) e Colour index, la denominazione chimica, la denominazione IUPAC (International Union of Pure and Applied Chemistry), la denominazione INCI, la denominazione della Farmacopea europea, la denominazione comune internazionale dell'OMS e la denominazione della nomenclatura comune prevista dall'inventario europeo degli ingredienti cosmetici, se esistono;
2) la denominazione ELINCS (European List of Notified Chemical Substances) e il numero ufficiale che è stato attribuito all'ingrediente in caso di notificazione sulla base della direttiva 67/548/CEE del Consiglio, nonché l'indicazione del riconoscimento o del rifiuto di riconoscimento della riservatezza sulla base dell'articolo 19 della stessa direttiva;
3) il nome della sostanza costitutiva di base, il nome della parte di pianta o di animale utilizzata, il nome dei componenti l'ingrediente, quali i solventi, nel caso in cui nomi e numeri di cui ai numeri 1) e 2) non esistano, ad esempio quando si tratta di ingredienti di origine naturale;
c) la valutazione della sicurezza per la salute umana dell'ingrediente utilizzato nel prodotto finito, tenendo conto del profilo tossicologico, della struttura chimica e del livello di esposizione dell'ingrediente, secondo le condizioni di cui all'articolo 10-ter;
d) il prevedibile uso dell'ingrediente ed in particolare le varie categorie di prodotti in cui sarà utilizzato;
e) una documentazione dettagliata dei motivi per i quali è richiesta, a titolo eccezionale, la riservatezza come, ad esempio:
1) il fatto che l'identità dell'ingrediente o la sua funzione nel prodotto cosmetico da immettere in commercio non è descritta nella letteratura o è sconosciuta alle regole dell'arte;
2) il fatto che l'informazione non è ancora di dominio pubblico, pur essendo già depositata una richiesta di brevetto per l'ingrediente o per la sua utilizzazione;
3) il fatto che se l'informazione fosse nota l'ingrediente o il procedimento sarebbero facilmente riproducibili, con pregiudizio del richiedente;
f) il nome di ciascun prodotto che conterrà l'ingrediente, se è noto, e, se si prevede di utilizzare diverse denominazioni sul mercato comunitario, l'elenco delle stesse. Se il nome del prodotto non è ancora noto, la comunicazione potrà essere effettuata successivamente, ma comunque almeno quindici giorni prima dell'immissione sul mercato del prodotto stesso. Se l'ingrediente è utilizzato in una pluralità di prodotti della stessa impresa, è sufficiente una sola domanda, purché tali prodotti siano chiaramente indicati al Ministero;
g) una dichiarazione che precisi se una domanda è stata presentata all'autorità competente di un altro Stato membro, nonché informazioni in merito al seguito dato a tale domanda.
3. Dopo avere ricevuto una domanda di riservatezza conforme al disposto del comma 2, il Ministero la esamina entro un termine non superiore a centoventi giorni e informa per iscritto il richiedente sul suo esito. In caso di accoglimento, il Ministero comunica inoltre al richiedente il numero di registrazione attribuito all'ingrediente secondo le modalità di cui all'allegato VII. Tuttavia, per motivi eccezionali, il Ministero può informare per iscritto il richiedente circa la necessità di un periodo di tempo supplementare, in ogni caso non superiore a sessanta giorni, per esaminare la domanda.
4. Il rifiuto del riconoscimento della riservatezza deve essere motivato e vengono chiaramente indicati al richiedente i mezzi di ricorso ed i relativi termini di presentazione.
5. Il numero di registrazione di cui al comma 3 sostituisce la denominazione dell'ingrediente nell'elenco di cui all'articolo 8, comma 1, lettera h).
6. Ogni modificazione delle informazioni fornite secondo il comma 2 deve essere comunicata quanto prima al Ministero e comunque almeno quindici giorni prima dell'immissione in commercio del prodotto per il quale è stata concessa la riservatezza di un ingrediente. La modifica della denominazione dei prodotti cosmetici in cui è contenuto l'ingrediente viene comunicata al Ministero almeno quindici giorni prima dell'immissione sul mercato dei prodotti sotto tale nuova denominazione.
7. Tenuto conto delle modificazioni di cui al comma 6 o nel caso in cui nuovi elementi, in particolare motivi imperativi di sanità pubblica, lo impongano, il Ministero può revocare il riconoscimento della riservatezza; in tal caso informa il richiedente della decisione entro i termini e secondo le modalità di cui al comma 4.
8. Il riconoscimento della riservatezza ha una durata di validità di cinque anni. Tuttavia il destinatario della decisione, se ritiene che sussistano motivi eccezionali che giustificano una proroga di tale durata, può presentare una domanda motivata presso il Ministero che si pronuncia sulla stessa entro i termini e secondo le modalità di cui ai commi 3 e 4. La proroga non può superare i tre anni.
9. Le spese derivanti dalle attività di cui ai commi 3 e 8 sono a carico del richiedente, secondo tariffe e modalità da stabilirsi con decreto del Ministro della sanità di concerto con i Ministri dell'industria, del commercio e dell'artigianato e del tesoro.
10. Il Ministero informa la Commissione europea e gli altri Stati membri dell'Unione europea in merito alle proprie decisioni di riconoscimento di proroga della riservatezza indicando il nome o la ragione sociale e l'indirizzo o la sede legale del richiedente, i nomi dei prodotti cosmetici che contengono l'ingrediente per il quale la risevatezza è stata concessa, nonché il numero di registrazione di cui al comma 3. La Commissione e gli altri Stati membri possono ottenere, a richiesta, una copia del fascicolo contenente la domanda di riservatezza nonché la decisione del Ministero.
11. Il Ministero informa la Commissione e gli altri Stati membri in merito alle decisioni motivate di rifiuto o di revoca del riconoscimento della riservatezza, o di rifiuto della proroga.
12. Il Ministero adotta le misure necessarie affinché i dati riservati non siano indebitamente divulgati.
13. Il Ministero riconosce le decisioni adottate dalle altre autorità competenti degli Stati membri in materia di riconoscimento o di proroga della riservatezza. Tuttavia, se il Ministero contesta una decisione adottata dall'autorità competente di un altro Stato membro, può chiedere alla Commissione di adottare una decisione in base alla procedura prevista dall'articolo 10 della direttiva del Consiglio 76/768/CEE, e successive modificazioni.
14. Salvo che il fatto costituisca reato, chiunque divulga indebitamente dati qualificati riservati ai sensi del presente articolo è soggetto alla sanzione amministrativa da lire un milione a lire dieci milioni.
1. E' vietato usare nell'etichettatura, nella presentazione alla vendita e nella pubblicità dei prodotti cosmetici testi, denominazioni, marchi, immagini ed altri segni figurativi o meno, che attribuiscano a tali prodotti caratteristiche non previste dall'art. 1.
1 bis. [Quando nell'etichettatura, nella presentazione alla vendita e nella pubblicità dei prodotti cosmetici viene fatto riferimento a prove effettuate su animali, sulla stessa etichetta, nella stessa presentazione alla vendita e nella stessa pubblicità deve essere chiaramente indicato se il produttore o i suoi fornitori hanno effettuato direttamente o commissionato a terzi tali esperimenti e se essi riguardano il prodotto cosmetico finito oppure i suoi ingredienti o entrambi]. [25]
2. Salva in ogni caso l'applicazione delle sanzioni penali qualora il fatto costituisca reato, chiunque contravviene alle disposizioni del precedente comma 1 soggiace alla sanzione amministrativa da lire 500.000 a lire 5.000.000 ed è tenuto a pubblicare una rettifica con gli stessi mezzi e lo stesso risalto utilizzati nella pubblicità, nel modo e nei termini stabiliti dall'autorità sanzionatoria; in caso di mancato adempimento della pubblicazione della rettifica, la sanzione amministrativa è raddoppiata.
2 bis. Salvo che il fatto costituisca reato, chiunque contravviene alle disposizioni di cui al comma 1 bis soggiace alla sanzione amministrativa da lire un milione a lire sei milioni. [26]
3. Nei messaggi pubblicitari autorizzati con licenze di pubblicità sanitarie rilasciate dal Ministero della sanità, non potranno essere attribuite finalità cosmetiche a prodotti registrati come presidi medico-chirurgici o come specialità medicinali.
1. La produzione ed il confezionamento dei prodotti cosmetici devono essere effettuati in officine con locali ed attrezzature igienicamente idonei allo scopo e sotto la direzione tecnica di un laureato in chimica, in chimica industriale, in chimica e farmacia, in chimica e tecnologia farmaceutica, in ingegneria chimica, in farmacia, in scienze biologiche, iscritto al relativo albo professionale o in possesso del titolo di equivalente disciplina universitaria di un paese della Comunità economica europea, con cui viga regime di reciprocità.
2. Il direttore tecnico svolge la sua attività con un rapporto di lavoro che può essere di tipo professionale.
3. Il direttore tecnico è responsabile della corretta esecuzione delle operazioni di produzione e confezionamento conformemente alle buone pratiche di fabbricazione, di cui al comma 4 o, in mancanza, alle disposizioni del
3 bis. L'importazione dei prodotti cosmetici da Paesi non membri dell'Unione europea deve avvenire sotto la responsabilità di un esperto avente i requisiti di cui ai commi 1 e 2, il quale è tenuto a valutare il metodo di fabbricazione utilizzato per i prodotti stessi. [28]
4. Con decreto del Ministro della sanità, di concerto con i Ministri dell'industria, del commercio e dell'artigianato e del lavoro e della previdenza sociale sono fissate ed aggiornate le buone pratiche di fabbricazione dei prodotti cosmetici anche sulla base delle norme comunitarie. [29]
5. Chiunque intenda produrre o confezionare in proprio e per conto terzi i prodotti di cui all'art. 1 deve darne comunicazione scritta almeno trenta giorni prima dell'inizio dell'attività al Ministero della sanità e alla regione.
6. La comunicazione deve contenere:
a) l'indicazione del nome o la ragione sociale e la sede legale dell'impresa e dell'officina di produzione;
b) la descrizione dei locali e delle attrezzature dalla quale risulti che essi sono idonei sotto il profilo tecnico ed igienico al tipo di produzione che si intende effettuare e la documentazione comprovante l'acquisto o il leasing delle attrezzature sopradette;
c) le generalità e la qualifica del direttore tecnico;
d) l'elenco completo e dettagliato delle sostanze impiegate e di quelle contenute nel prodotto commerciale.
7. Ogni modificazione dei dati di cui al comma 6 deve formare oggetto di nuova, preventiva comunicazione. [30]
8. Analoga comunicazione, limitatamente alle lettere a) e d) del comma 6, deve essere fatta dagli importatori di prodotti in confezioni pronte alla vendita provenienti da Paesi membri dell'Unione europea, mentre gli importatori da Paesi non membri dell'Unione europea devono trasmettere comunicazione anche relativamente alle generalità ed alla qualificazione dell'esperto di cui al comma 3 bis. [31]
8 bis. Il Ministro della sanità può stabilire, con decreto, che i dati relativi alle sostanze previsti nei commi 6, 7 e 8, ivi compresi quelli già comunicati, siano forniti al Ministero e alle regioni, eventualmente tramite le associazioni di categoria, mediante idoneo supporto magnetico, secondo le modalità precisate nello stesso decreto. [32]
9. Entro i mesi di gennaio e di luglio di ciascun anno le regioni danno notizia al Ministero della sanità, mediante appositi elenchi, delle comunicazioni ricevute nel semestre precedente.
10. Il Ministero della sanità effettua in qualsiasi momento ispezioni agli stabilimenti di produzione al fine di acquisire elementi per l'espletamento dei compiti affidati dalla presente legge.
11. In qualsiasi momento l'autorità sanitaria competente può accedere nei locali al fine di effettuare ispezioni e può disporre l'adozione di particolari cautele e l'esecuzione dei lavori onde adeguare i locali e le attrezzature tecniche e di controllo alla produzione o al confezionamento che si intende effettuare, in armonia con le disposizioni previste dal decreto ministeriale di cui al comma 4.
12. Le imprese produttrici ed importatrici devono conservare per un periodo di tre anni, anche dopo la cessazione della produzione e del deposito, la documentazione relativa alla composizione qualitativa e quantitativa del prodotto ed ai processi produttivi.
12 bis. In caso di cessazione dell'attività, i produttori e gli importatori devono darne comunicazione al Ministero della sanità e alla regione, entro sessanta giorni. [33]
13. Nel caso di prodotti cosmetici "allo stato estero" il competente organo della vigilanza sanitaria - previo accertamento di tale condizione da parte delle competenti autorità doganali - può accedere agli spazi doganali, effettuando le operazioni di prelievo in collaborazione con il personale del Ministero delle finanze e con l'assistenza del vettore o del suo rappresentante in loco.
14. La suddetta operazione di prelievo può essere effettuata con le medesime garanzie, presso le imprese destinatarie, se i prodotti cosmetici sono importati con la procedura semplificata, a termini degli articoli 232 e seguenti del testo unico delle disposizioni legislative in materia doganale approvato con
15. Salvo che il fatto costituisca reato, chiunque contravviene alle disposizioni dei commi 1, 3 bis, 5, 6, 7, 8 e 12 bis, a quelle impartite dall'autorità sanitaria competente ai sensi del comma 11 e a quelle emanate con i decreti di cui ai commi 4 e 8-bis è soggetto alla sanzione amministrativa da lire un milione a lire sei milioni. [34]
1. Con decreto del Ministro della sanità, di concerto con il Ministro dell'industria, del commercio e dell'artigianato, sono stabiliti gli adempimenti che devono essere osservati per assicurare l'agevole individuazione dell'importatore in ogni fase della distribuzione e della vendita di cosmetici provenienti dall'estero.
2. In caso di inosservanza degli adempimenti di cui al comma 1, si applica la sanzione amministrativa pecuniaria consistente nel pagamento di una somma da lire un milione a lire sei milioni.
1. Il produttore o il suo mandatario o la persona per conto della quale un prodotto cosmetico viene fabbricato oppure il responsabile dell'immissione sul mercato di un prodotto cosmetico importato da Paesi non appartenenti all'Unione europea tiene ad immediata disposizione del Ministero della sanità - Dipartimento per la valutazione dei medicinali e la farmacovigilanza, ai fini dell'esercizio del controllo, all'indirizzo specificato in etichetta come previsto all'articolo 8, comma 1, lettera a), le seguenti informazioni:
a) la formula qualitativa e quantitativa del prodotto; per i composti odoranti e i profumi, le informazioni si limitano al nome e al numero di codice del composto e all'indentità del fornitore;
b) le specifiche fisico-chimiche e microbiologiche delle materie prime e del prodotto finito e i criteri di purezza e i criteri di controllo microbiologico dei prodotti cosmetici;
c) il metodo di fabbricazione conformemente alle buone pratiche di fabbricazione;
d) la valutazione della sicurezza per la salute umana del prodotto finito. A tale riguardo, il fabbricante prende in considerazione il profilo tossicologico generale degli ingredienti, la struttura chimica e il livello d'esposizione. Prende in considerazione in particolare le caratteristiche peculiari dell'esposizione delle parti sulle quali il prodotto viene applicato o la popolazione alla quale il prodotto è destinato. In particolare, effettua, tra l'altro, una specifica valutazione dei prodotti cosmetici destinati a bambini di età inferiore a tre anni e di quelli destinati unicamente all'igiene intima esterna [37];
e) il nome e l'indirizzo delle persone qualificate responsabili della valutazione di cui alla lettera d). Tali persone devono essere in possesso di uno dei seguenti diplomi di laurea o in possesso del titolo di equivalente disciplina universitaria di un Paese dell'Unione europea: in medicina e chirurgia, in scienze biologiche, in farmacia, in chimica e tecnologie farmaceutiche, in chimica o in chimica industriale; qualora il valutatore sia, invece, in possesso di un titolo di studio conseguito ai sensi del
f) i dati esistenti per quanto riguarda gli effetti indesiderabili per la salute umana provocati dal prodotto cosmetico in seguito alla sua utilizzazione;
g) le prove degli effetti attribuiti al prodotto cosmetico qualora la natura degli effetti o del prodotto lo giustifichi;
g-bis) i dati concernenti le sperimentazioni animali effettuate dal fabbricante, dai suoi agenti o dai suoi fornitori relativamente allo sviluppo o alla valutazione della sicurezza del prodotto o dei suoi ingredienti, inclusi gli esperimenti sugli animali effettuati per soddisfare i requisiti legislativi o regolamentari di Paesi non membri [38].
2. Le aziende produttrici e distributrici di materie prime destinate ai prodotti cosmetici sono tenute a fornire agli acquirenti tutte le informazioni necessarie alla predisposizione della documentazione di cui alla lettera b) e alla valutazione della sicurezza prevista alla lettera d) del comma 1, anche mediante dati sul potere irritante ed allergizzante delle sostanze.
3. Con decreto del Ministro della sanità, di concerto con il Ministro dell'industria, del commercio e dell'artigianato, sulla base di disposizioni comunitarie, sono definite linee guida sugli obblighi di informazione di cui al comma 2 e sulla compilazione delle informazioni di cui al comma 1.
4. La valutazione della sicurezza per la salute umana di cui al comma 1, lettera d), viene effettuata conformemente ai principi di buone pratiche di laboratorio, così come previsti nel
5. Le informazioni di cui al comma 1 devono essere disponibili in lingua italiana o in lingua inglese o francese.
6. Il produttore o il suo mandatario o la persona per conto della quale il prodotto cosmetico viene fabbricato oppure il responsabile dell'immissione sul mercato del prodotto cosmetico importato da Paesi non appartenenti alla Unione europea deve comunicare al Ministero della sanità - Dipartimento per la valutazione dei medicinali e la farmacovigilanza, l'indirizzo dei luoghi di fabbricazione o di prima importazione nell'Unione europea dei prodotti cosmetici prima dell'immissione sul mercato, nonché l'indirizzo del luogo di detenzione delle informazioni di cui al comma 1, qualora diverso da quello indicato in etichetta.
7. Se la fabbricazione del prodotto cosmetico avviene in officine o sedi ubicate anche in altri Paesi dell'Unione europea, il fabbricante può scegliere anche un solo luogo di fabbricazione dove tenere a disposizione le informazioni di cui al comma 1, lettere a), b), c) e d). Il fabbricante comunica al Ministero della salute l'indirizzo del luogo ove le informazioni sono detenute, garantendo che le stesse siano facilmente accessibili [39].
8. Ogni modificazione dei dati di cui ai commi 6 e 7 deve formare oggetto di nuova preventiva comunicazione.
9. Salvo che il fatto non costituisca reato chiunque contravviene alle disposizioni di cui ai commi 1, 2 e 4 è soggetto alla sanzione amministrativa da lire dieci milioni a lire cento milioni, chiunque contravviene alle disposizioni di cui ai commi 5, 6 e 8 è soggetto alla sanzione amministrativa da lire cinque milioni a lire cinquanta milioni.
9-bis. Fatta salva la tutela della segretezza commerciale e dei diritti di proprietà intellettuale, il Ministero della salute garantisce che le informazioni richieste ai sensi del comma 1, lettere a) e f), siano rese facilmente accessibili al pubblico con ogni mezzo idoneo, inclusi i mezzi elettronici. Le informazioni quantitative di cui alla lettera a) che devono essere messe a disposizione del pubblico sono limitate alle sostanze che corrispondono ai criteri relativi a una delle seguenti classi o categorie di pericolo di cui all'allegato I del
1) classi di pericolo da 2.1 a 2.4, 2.6 e 2.7, 2.8 tipi A e B, 2.9, 2.10, 2.12, 2.13 categorie 1 e 2, 2.14 categorie 1 e 2, 2.15 tipi da A a F;
2) classi di pericolo da 3.1 a 3.6, 3.7 effetti nocivi sulla funzione sessuale e la fertilità o sullo sviluppo, 3.8 effetti diversi dagli effetti narcotici, 3.9 e 3.10;
3) classe di pericolo 4.1;
4) classe di pericolo 5.1 [40].
1. Il Ministero della sanità e l'autorità sanitaria territorialmente competente in base all'ubicazione dei locali di cui al comma 3 possono procedere in qualunque momento al prelievo di campioni di prodotti cosmetici, con le modalità stabilite dal decreto ministeriale di cui all'articolo 7. [41]
2. Sino alla emanazione del decreto di cui all'art. 7 il prelievo viene effettuato con le modalità in uso per i prodotti farmaceutici.
3. Il prelievo può essere effettuato presso l'officina di produzione, o di confezionamento o presso il deposito dell'importatore o del distributore ubicati nel territorio soggetto alla vigilanza dell'autorità sanitaria che effettua il prelievo. E' comunque ammesso il campionamento presso esercizi di commercio al dettaglio qualora non risulti possibile o non risulti utile ai fini sanitari procedere al campionamento nelle sedi previste dal primo periodo del presente comma. [42]
3 bis. Le regioni e le province autonome assicurano che, in un arco di tempo dalle stesse determinato, tutti gli stabilimenti di produzione ed i magazzini degli importatori, anche da Paesi comunitari, situati nei territori di rispettiva competenza, vengano sottoposti ad ispezioni finalizzate a verificare l'osservanza delle disposizioni della presente legge, tenuto conto altresì del sistema di certificazione di qualità eventualmente adottato. Gli esiti non favorevoli delle ispezioni vengono comunicati al Ministero della sanità. [43]
3 ter. Al fine di garantire un idoneo sistema di sorveglianza sul territorio nazionale, le autorità sanitarie regionali e locali trasmettono al Ministero della sanità, entro i mesi di gennaio e luglio di ogni anno, i dati relativi agli effetti indesiderati comunque correlati all'uso di prodotti cosmetici. Il Ministro della sanità stabilisce le modalità attraverso le quali i cittadini possono segnalare gli eventuali effetti indesiderati dei prodotti cosmetici. [44]
4. Quando dalle analisi, sia qualitative che quantitative, dei campioni prelevati possa ipotizzarsi un illecito sanzionato penalmente, l'autorità sanitaria, oltre a trasmettere il rapporto all'autorità giudiziaria e a darne comunicazione agli interessati, ne informa il Ministero della sanità.
5. Entro quindici giorni dalla data di ricevimento della comunicazione, gli interessati potranno presentare all'autorità competente istanza di revisione in bollo.
6. Ove dalle analisi risulti un illecito amministrativo, si applicano le disposizioni contenute nell'art. 15 della
7. Le imprese sono tenute a fornire le specifiche e motivate informazioni richieste dal Ministero della sanità o dall'autorità sanitaria competente sulle sostanze contenute nei prodotti, unitamente alle indicazioni ed istruzioni delle relative confezioni.
8. A tal fine le imprese devono conservare costantemente aggiornati i dati relativi alla composizione qualitativa e quantitativa dei singoli prodotti.
9. Il Ministero della sanità entro trenta giorni dalla data di entrata in vigore della presente legge, indica l'ufficio territoriale competente a richiedere le informazioni di cui al comma 7.
9 bis. Il Ministro della sanità - Dipartimento per la valutazione dei medicinali e la farmacovigilanza è l'autorità competente a richiedere le informazioni di cui al comma 1 dell'articolo 10-ter. Il Dipartimento si avvale, se del caso, dell'Istituto superiore di sanità e del Consiglio superiore di sanità per la valutazione di tali informazioni e dei dati trasmessi dalle autorità regionali e locali ai sensi del comma 3 ter. [45]
9 ter. A richiesta dell'autorità di cui al comma 9-bis sono pubblicate nella Gazzetta Ufficiale le comunicazioni relative ai ritiri dal mercato dei prodotti cosmetici. La stessa autorità provvede a rendere pubblici in un'apposita comunicazione semestrale i dati relativi agli effetti indesiderati. [46]
10. Le imprese che contravvengono al disposto dei commi 7 e 8 del presente articolo sono soggette alla sanzione amministrativa da lire 500.000 a lire 5.000.000.
1. Le sanzioni previste dalla presente legge non si applicano al commerciante che detiene, pone in vendita o comunque distribuisce per il consumo prodotti cosmetici in confezioni originali, qualora la mancata rispondenza alle prescrizioni della legge stessa riguardi i requisiti intrinseci o la composizione dei prodotti o le condizioni interne dei recipienti e sempre che il commerciante non sia a conoscenza della violazione e la confezione non presenti segni di alterazione.
1. All'applicazione delle sanzioni amministrative previste dalla presente legge provvede l'autorità amministrativa competente ai sensi delle leggi regionali con le modalità di cui alla
1. Coloro i quali alla data di entrata in vigore della presente legge esercitano da almeno tre anni la funzione di direttore tecnico di cui all'art. 10, pur essendo sprovvisti di una delle lauree ivi indicate, possono proseguire nell'attività stessa, purchè entro quattro mesi documentino alla competente autorità regionale la medesima attività e ottengano il corrispondente attestato abilitante.
2. L'autorità predetta, sulla base della documentazione acquisita, entro sessanta giorni dalla data di ricevimento della medesima, rilascia ai richiedenti un attestato abilitante alla direzione tecnica della produzione documentata, dandone comunicazione al Ministero della sanità.
1. Dalla data di entrata in vigore della presente legge è vietato impiegare nella preparazione di cosmetici sostanze incluse nell'allegato II. I produttori e gli importatori di cosmetici contenenti tali sostanze devono ritirare i prodotti dal commercio entro trenta giorni dalla data predetta.
2. I prodotti cosmetici non conformi alle prescrizioni di cui al precedente art. 8, salvo quanto previsto ai commi successivi, non possono essere immessi in commercio da produttori ed importatori dopo sei mesi dalla data di entrata in vigore della presente legge.
3. I prodotti cosmetici non conformi alle prescrizioni di cui agli allegati III, IV e V, sezione prima, della presente legge, non possono essere immessi in commercio da produttori ed importatori dopo sei mesi dall'entrata in vigore della presente legge.
4. Dopo il 31 dicembre 1987 i prodotti non conformi alle prescrizioni richiamate nel comma 3 non possono più essere venduti o comunque ceduti al consumatore.
5. I prodotti cosmetici non conformi alle prescrizioni di cui all'allegato V, sezione seconda, della presente legge, non possono essere immessi in commercio da produttori ed importatori dopo il 31 dicembre 1986.
6. Dopo il 31 dicembre 1988 i prodotti non conformi alle prescrizioni richiamate nel precedente comma 5 non possono più essere venduti o comunque ceduti al consumatore.
7. Chiunque produce, confeziona o importa prodotti cosmetici alla data di entrata in vigore della presente legge può proseguire nell'attività purchè presenti la comunicazione di cui ai commi 5, 6, 7 e 8 dell'art. 10 entro novanta giorni dalla predetta data.
8. Chi viola il disposto del comma 1 del presente articolo soggiace alle pene previste nel comma 1, primo periodo, dell'art. 3.
9. Chi viola le disposizioni previste dai commi 3 e 5 del presente articolo soggiace alle pene di cui al comma 1, secondo periodo, dell'art. 3, ovvero a quelle previste dai commi 2 e 3 del medesimo art. 3, a seconda che la non conformità attenga alla presenza di sostanze non comprese negli allegati o al mancato rispetto dei limiti e delle condizioni stabilite per le sostanze comprese negli allegati stessi.
10. Le pene richiamate nel comma 9 si applicano, altresì, in caso di violazione delle disposizioni di cui ai commi 4 e 6 del presente articolo.
11. Chi viola la disposizione del comma 7 del presente articolo soggiace alle sanzioni previste dal comma 15 dell'art. 10.
1. Dalla data di entrata in vigore della presente legge cessano di avere efficacia, nei confronti dei prodotti cosmetici, l'art. 251 del testo unico delle leggi sanitarie, approvato con
1. Entro centoventi giorni dalla data di entrata in vigore della presente legge, a cura del Ministero della sanità sono pubblicati nella Gazzetta Ufficiale della Repubblica italiana gli elenchi di cui agli allegati II, III, IV e V, con aggiunta, accanto alle denominazioni ivi indicate, della denominazione comune italiana o internazionale o di sinonimi o numeri di codice di identificazione utili ad una più agevole comprensione degli elenchi medesimi.
Allegato I
Elenco indicativo per categoria dei prodotti cosmetici
Creme, emulsioni, lozioni, gel e oli per la pelle (mani, piedi, viso, ecc.)
Maschere di bellezza (ad esclusione dei prodotti per il peeling)
Fondotinta (liquidi, paste, ciprie)
Cipria per il trucco, talco per il dopobagno e per l'igiene corporale, ecc.
Saponi da toeletta, saponi deodoranti, ecc.
Profumi, acque da toaletta ed acqua di colonia
Preparazioni per bagni e docce (sali, schiume, oli, gel, ecc.)
Prodotti per la depilazione
Deodoranti ed antisudoriferi
Prodotti per il trattamento dei capelli:
- tinture per capelli e decoloranti
- prodotti per l'ondulazione, la stiratura e il fissaggio
- prodotti per la messa in piega
- prodotti per pulire i capelli (lozioni, polveri, shampoo)
- prodotti per mantenere i capelli in forma (lozioni, creme, oli)
- prodotti per l'acconciatura dei capelli (lozioni, lacche, brillantine)
Prodotti per la rasatura (saponi, schiume, lozioni, ecc.)
Prodotti per il trucco e lo strucco del viso e degli occhi
Prodotti destinati ad essere applicati sulle labbra
Prodotti per l'igiene dei denti e della bocca
Prodotti per l'igiene delle inghie e lacche per le stesse
Prodotti per l'igiene intima esterna
Prodotti solari
Prodotti abbronzanti senza sole
Prodotti per schiarire la pelle
Prodotti antirughe.
Allegato II
Elenco delle sostanze che non possono entrare nella composizione dei prodotti cosmetici
(Omissis)
Allegato III
(Omissis)
Allegato IV
(Omissis)
(Omissis)
ALLEGATO VI [47]
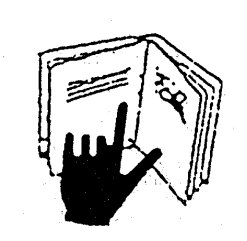
ALLEGATO VI BIS [48]
(articolo 1, comma 1, lettera h))
Simbolo rappresentante un barattolo di crema aperto secondo quanto disposto dall'articolo 8, comma 1, lettera c).
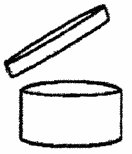
ALLEGATO VII [49]
Modalità di attribuzione del numero di registrazione di cui all'articolo 8-bis, comma 3.
1. Il numero di registrazione di cui all'articolo 8-bis, comma 3, comprende sette cifre: le prime due corrispondono all'anno di riconoscimento della riservatezza, le due seguenti al codice attribuito a ciascuno Stato membro, in conformità con il seguente punto 2, le tre ultime sono attribuite all'autorità competente.
2. Sono attribuiti a ciascuno Stato membro i seguenti codici:
01 Francia
02 Belgio
03 Paesi Bassi
04 Germania
05 Italia
06 Regno Unito
07 Irlanda
08 Danimarca
09 Lussemburgo
10 Grecia
11 Spagna
12 Portogallo
13 Finlandia
14 Austria
15 Svezia
16 Repubblica ceca
17 Estonia
18 Cipro
19 Lettonia
20 Lituania
21 Ungheria
22 Malta
23 Polonia
24 Slovenia
25 Slovacchia
26 Bulgaria
27 Romania
Allegato VIII [50]
Elenco dei metodi convalidati alternativi alla sperimentazione animale
Il presente allegato elenca i metodi alternativi convalidati dal Centro europeo per la convalida di metodi alternativi (ECVAM) del Centro comune di ricerca che possono rispondere ai requisiti della presente legge che non sono elencati nel
|
Numero di riferimento |
Metodi alternativi convalidati |
Sostituzione totale o parziale |
|
A |
B |
C |
[1] Abrogata dall'art. 19 del
[2] Comma così sostituito dall'art. 2 del
[3] Comma così sostituito dall'art. 2del
[4] Termine rinviato, da ultimo, al 30 giugno 2002 dall'art. 1 del D.M. 6 luglio 2000.
[5] Comma aggiunto dall'art. 3 del
[6] Comma aggiunto dall'art. 3 del
[7] Comma inserito dall'art. 3 del
[8] Articolo inserito dall'art. 1 del
[9] Lettera così sostituita dall'art. 1 del D.M. 23 marzo 2011.
[10] Articolo inserito dall'art. 1 del
[11] Comma così sostituito dall'art. 1 del D.M. 23 marzo 2011.
[12] Comma sostitutito dall'art. 4 del
[13] Comma aggiunto dall'art. 4 del
[14] Comma così sostituito dall'art. 5 del
[15] Comma così modificato dall'art. 5 del
[16] Articolo già sostituito dall'art. 3 del
[17] Lettera così sostituita dall'art. 1 del
[18] Lettera così sostituita dall'art. 1 del
[19] Comma già modificato dall'art. 28 della
[20] Comma così sostituito dall'art. 1 del
[21] Comma così sostituito dall'art. 1 del
[22] Comma così sostituito dall'art. 1 del
[23] Comma inserito dall'art. 1 del
[24] Articolo inserito dall'art. 7 del
[25] Comma inserito dall'art. 8 del
[26] Comma inserito dall'art. 8 del
[27] Comma così sostituito dall'art. 9 del
[28] Comma inserito dall'art. 9 del
[29] Comma così sostituito dall'art. 9 del
[30] Comma così sostituito dall'art. 4 del
[31] Comma già sostituito dall'art. 4 del
[32] Comma aggiunto dall'art. 4 del
[33] Comma aggiunto dall'art. 4 del
[34] Comma già sostituito dall'art. 4 del
[35] Articolo inserito dall'art. 5 del
[36] Articolo inserito dall'art. 10 del
[37] Lettera così sostituita dall'art. 1 del
[38] Lettera aggiunta dall'art. 1 del
[39] Comma così sostituito dall'art. 1 del
[40] Comma aggiunto dall'art. 1 del
[41] Comma così sostituito dall'art. 11 del
[42] Comma così sostituito dall'art. 11 del
[43] Comma aggiunto dall'art. 11 del
[44] Comma aggiunto dall'art. 11 del
[45] Comma inserito dall'art. 11 del
[46] Comma inserito dall'art. 11 del
[47] Allegato aggiunto dall'art. 12 del
[48] Allegato inserito dall’art. 1 del
[49] Allegato aggiunto dall'art. 12 del
[50] Allegato aggiunto dal D.M. 8 febbraio 2005 e così modificato dall'art. 1 del D.M. 23 marzo 2011.