Adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2019/6 del Parlamento europeo e del Consiglio dell'11 dicembre 2018 [...]
| Settore: | Normativa nazionale |
| Materia: | 97. Zootecnia |
| Capitolo: | 97.7 servizi veterinari |
| Data: | 07/12/2023 |
| Numero: | 218 |
| Sommario |
| Art. 1. Finalità |
| Art. 2. Definizioni |
| Art. 3. Autorità competenti e altro personale afferente alle autorità competenti |
| Art. 4. Sperimentazioni cliniche |
| Art. 5. Autorizzazioni all'immissione in commercio |
| Art. 6. Classificazione dei medicinali veterinari |
| Art. 7. Riassunto delle caratteristiche del prodotto, etichettatura e foglietto illustrativo |
| Art. 8. Autorizzazione all'immissione in commercio di medicinali veterinari per animali tenuti esclusivamente come animali da compagnia |
| Art. 9. Registrazione dei medicinali veterinari omeopatici |
| Art. 10. Impiego dei medicinali omeopatici ad uso umano |
| Art. 11. Sistema nazionale di farmacovigilanza |
| Art. 12. Compiti e funzioni delle autorità competenti nel Sistema nazionale di farmacovigilanza |
| Art. 13. Farmacovigilanza. Segnalazione di sospetti eventi avversi |
| Art. 14. Autorizzazione alla fabbricazione di medicinali veterinari e certificati di buona pratica di fabbricazione |
| Art. 15. Registrazione delle attività di importazione e di fabbricazione delle sostanze attive ad uso veterinario |
| Art. 16. Sistemi informativi e tracciabilità dei medicinali veterinari |
| Art. 17. Autorizzazione alla distribuzione all'ingrosso di medicinali veterinari |
| Art. 18. Distribuzione all'ingrosso da parte dei titolari delle autorizzazioni all'immissione in commercio |
| Art. 19. Depositari di medicinali veterinari |
| Art. 20. Disposizioni specifiche per la fornitura di ossigeno e di altri gas medicinali |
| Art. 21. Distribuzione di sostanze attive |
| Art. 22. Commercio parallelo di medicinali veterinari |
| Art. 23. Vendita al dettaglio e vendita diretta |
| Art. 24. Prescrizioni a carico del titolare dell'autorizzazione alla vendita al dettaglio o diretta |
| Art. 25. Casi particolari di dispensazione dei medicinali veterinari |
| Art. 26. Vendita in altri esercizi commerciali |
| Art. 27. Vendita al dettaglio di medicinali veterinari a distanza |
| Art. 28. Prescrizione veterinaria |
| Art. 29. Impiego di medicinali antimicrobici |
| Art. 30. Impiego di medicinali veterinari non autorizzati in Italia |
| Art. 31. Scorte di medicinali |
| Art. 32. Modalità di tenuta e gestione delle scorte presso gli stabilimenti in cui si allevano e si detengono animali |
| Art. 33. Modalità di tenuta e gestione delle scorte presso le strutture sanitarie di cura degli animali |
| Art. 34. Modalità di tenuta e gestione delle scorte da parte del medico veterinario nell'esercizio dell'attività zooiatrica |
| Art. 35. Utilizzo dei medicinali negli stabilimenti autorizzati ai sensi dell'articolo 20, comma 2, del decreto legislativo 4 marzo 2014 n. 26 |
| Art. 36. Modalità di conservazione e di utilizzo delle rimanenze di medicinali |
| Art. 37. Cessione dei medicinali veterinari |
| Art. 38. Pubblicità dei medicinali veterinari |
| Art. 39. Pubblicità di medicinali veterinari immunologici |
| Art. 40. Campioni gratuiti |
| Art. 41. Controlli e ispezioni |
| Art. 42. Sanzioni |
| Art. 43. Disposizioni tariffarie |
| Art. 44. Abrogazioni |
| Art. 45. Disposizioni transitorie e finali |
| Art. 46. Clausola di invarianza finanziaria |
§ 97.7.109 - D.Lgs. 7 dicembre 2023, n. 218.
Adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2019/6 del Parlamento europeo e del Consiglio dell'11 dicembre 2018 relativo ai medicinali veterinari e che abroga la direttiva 2001/82/CE, ai sensi dell'articolo 17 della legge 4 agosto 2022, n. 127.
(G.U. 3 gennaio 2024, n. 2)
IL PRESIDENTE DELLA REPUBBLICA
Visti gli articoli 9, 41, 76 e 87 della Costituzione;
Vista la
Vista la
Vista la
Visto il
Visto il
Vista la
Vista la
Vista la
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Vista la
Vista la
Vista la
Vista la
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il
Visto il testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope e di prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al
Visto il
Visto il decreto del Ministro della sanità 14 febbraio 1991, recante «Determinazione delle tariffe e dei diritti spettanti al Ministero della sanità, all'Istituto superiore di sanità e all'Istituto superiore per la prevenzione e sicurezza del lavoro, per prestazioni rese a richiesta e ad utilità dei soggetti interessati, pubblicato nella Gazzetta Ufficiale n. 63 del 15 marzo 1991;
Visto il decreto del Ministro della salute 12 novembre 2011, recante «Buone pratiche di sperimentazione clinica dei medicinali veterinari sugli animali», pubblicato nella Gazzetta Ufficiale n. 291 del 15 dicembre 2011;
Vista la preliminare deliberazione del Consiglio dei ministri, adottata nella riunione del 26 luglio 2023.;
Acquisito il parere della Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano espresso nella seduta del 6 settembre 2023;
Acquisiti i pareri delle competenti Commissioni parlamentari della Camera dei deputati e del Senato della Repubblica;
Vista la deliberazione del Consiglio dei ministri, adottata nella riunione del 5 dicembre 2023;
Sulla proposta del Ministro per gli affari europei, il Sud, le politiche di coesione e il PNRR e del Ministro della salute, di concerto con i Ministri della giustizia, dell'agricoltura, della sovranità alimentare e delle foreste, dell'ambiente e della sicurezza energetica, degli affari regionali e delle autonomie, degli affari esteri e della cooperazione internazionale, dell'università e della ricerca, dell'economia e finanze e delle imprese e del made in Italy;
Emana
il seguente decreto legislativo:
Titolo I
Disposizioni Generali
Art. 1. Finalità
1. Il presente decreto stabilisce le norme necessarie ad adeguare l'ordinamento giuridico nazionale alle disposizioni del
Art. 2. Definizioni
1. Ai fini del presente decreto si applicano le definizioni contenute nell'articolo 4 del regolamento nonchè quelle contenute:
a) negli atti delegati e di esecuzione del regolamento in quanto richiamate nel presente decreto;
b) nell'articolo 3 del
c) nell'articolo 4, punti 24) e 27), del
2. Ai fini del presente decreto, si intende per:
a) «depositario»: chi detiene, per la successiva commercializzazione, medicinali veterinari sulla base di contratti di deposito stipulati con i titolari dell'autorizzazione all'immissione in commercio dei medicinali veterinari o con i loro rappresentanti;
b) «sistema informativo di tracciabilità»: sistema informativo di tracciabilità dei medicinali veterinari e dei mangimi medicati e dei prodotti intermedi, composto dal Sistema della banca dati centrale della tracciabilità del farmaco (BDC) di cui all'articolo 5-bis del
Art. 3. Autorità competenti e altro personale afferente alle autorità competenti
1. Ai fini dell'applicazione del presente decreto, il Ministero della salute, le regioni, le province autonome di Trento e di Bolzano e le aziende sanitarie locali nell'ambito delle rispettive competenze, sono le autorità competenti a:
a) rilasciare i provvedimenti necessari all'esercizio delle attività relative alla fabbricazione, all'importazione, all'esportazione, all'immissione in commercio, incluso il commercio parallelo, alla fornitura, alla distribuzione, alla pubblicità, nonchè i provvedimenti relativi alla detenzione di scorte e all'impiego dei medicinali veterinari;
b) adottare i provvedimenti necessari all'esercizio delle attività relative alla fabbricazione, all'importazione e alla distribuzione all'ingrosso delle sostanze farmacologicamente attive;
c) adottare i provvedimenti di autorizzazione delle sperimentazioni cliniche ai sensi dell'articolo 4 del presente decreto;
d) classificare, secondo i criteri indicati all'articolo 34, paragrafo 1, del regolamento, e all'articolo 6 del presente decreto, i medicinali veterinari autorizzati all'immissione in commercio, nonchè i medicinali veterinari omeopatici registrati;
e) svolgere attività di farmacovigilanza;
f) assicurare l'adeguamento e il coordinamento dei sistemi informatici nazionali e l'interconnessione ai sistemi informatici istituiti con il regolamento e gestiti dall'Agenzia europea per i medicinali per le finalità previste dagli articoli 6, 55, 57, 58, 61, 67, 74, 76, 81, 88, 91, 92, 94, 95, 100, 132 e 155 del regolamento;
g) effettuare, ai sensi degli articoli 123 e 126 del regolamento, controlli e ispezioni e, in caso di accertamento di violazione delle disposizioni di cui al presente decreto, provvedere all'applicazioni delle sanzioni di cui all'articolo 42.
2. Il Ministero della salute coopera con le autorità competenti degli altri Stati membri nonchè con la Commissione e può avvalersi del Comando carabinieri per la tutela della salute, garantendo il coordinamento delle attività di accertamento con le attività di controllo svolte dalle altre autorità territorialmente competenti. Il personale del Comando dei carabinieri per la tutela della salute, nel caso rilevi la presenza di violazioni delle disposizioni nell'ambito delle attività di cui all'articolo 1 del regolamento, e del presente decreto, informa l'autorità competente dei provvedimenti adottati.
3. Le Forze di polizia e il personale afferente ad altre istituzioni che, nell'ambito dello svolgimento dei controlli condotti per la propria attività istituzionale, sospettano la presenza di violazioni delle disposizioni nell'ambito delle attività di cui all'articolo 1 del regolamento, ne danno, senza ritardo, segnalazione alle autorità competenti.
Titolo II
Immissione in commercio
Capo I
Sperimentazioni cliniche
Art. 4. Sperimentazioni cliniche
1. Il Ministero della salute è l'autorità competente ad autorizzare le sperimentazioni cliniche in conformità alle prescrizioni dettate dall'articolo 9 del regolamento, e secondo le procedure e le modalità tecniche di attuazione disposte con decreto del Ministro della salute, acquisiti i pareri del Comitato tecnico per la nutrizione e la sanità animale e della Conferenza permanente Stato, regioni e Province autonome di Trento e di Bolzano.
2. Nell'attività istruttoria il Ministero della salute si avvale dell'Istituto superiore di sanità per la valutazione delle istanze.
Capo II
Autorizzazione all'immissione in commercio
Art. 5. Autorizzazioni all'immissione in commercio
1. Un medicinale veterinario è immesso in commercio sul territorio nazionale soltanto a seguito dell'autorizzazione all'immissione in commercio da parte del Ministero della salute o della Commissione europea, ai sensi dell'articolo 5 del regolamento.
2. Il Ministero della salute è l'autorità competente a ricevere ed esaminare la domanda di autorizzazione all'immissione in commercio presentata mediante una delle procedure elencate nell'articolo 6, paragrafo 1, del regolamento, nonchè alla adozione del provvedimento finale di autorizzazione. Nell'esame della domanda di autorizzazione il Ministero della salute può avvalersi del parere dell'Istituto superiore di sanità o di altri enti pubblici o di enti privati accreditati dal medesimo Ministero.
3. Il Ministero della salute è l'autorità competente per l'esame della domanda e per la adozione del provvedimento di variazione dell'autorizzazione all'immissione in commercio del medicinale veterinario, di cui al capo IV, sezione 3, del regolamento, e per le procedure di armonizzazione del riassunto delle caratteristiche del prodotto di cui al capo IV, sezione 4, del regolamento.
4. Il Ministero della salute è l'autorità competente all'adozione delle misure di restrizione temporanea per motivi di sicurezza di cui all'articolo 129 del regolamento, nonchè all'adozione dei provvedimenti di sospensione, revoca e variazione dei termini di cui all'articolo 130 del regolamento, relativi alle autorizzazioni all'immissione in commercio.
5. Il Ministero della salute pubblica, sul proprio sito istituzionale, i provvedimenti di autorizzazione all'immissione in commercio ovvero le informazioni relative all'avvenuto ritiro della domanda di autorizzazione, i provvedimenti di modifica mediante variazione ai sensi dell'articolo 62 del regolamento, di diniego, di sospensione, di revoca o variazione dei termini di un'autorizzazione all'immissione in commercio di cui all'articolo 130 del regolamento, nonchè quelli relativi alle misure di restrizione temporanea per motivi di sicurezza di cui all'articolo 129 del regolamento.
Art. 6. Classificazione dei medicinali veterinari
1. Fatte salve le norme nazionali o dell'Unione più restrittive, il Ministero della salute classifica i medicinali veterinari autorizzati all'immissione in commercio o registrati secondo i criteri di cui all'articolo 34 del regolamento.
2. La tipologia di prescrizione indicata nella classificazione è stabilita, oltre che secondo i criteri di cui all'articolo 34 del regolamento, sulla base delle caratteristiche del medicinale veterinario e della posologia, e può essere ripetibile o non ripetibile.
3. In applicazione dell'articolo 106, paragrafo 4, del regolamento, sono riportate nell'allegato I al presente decreto, le tipologie di medicinali che, in ragione degli speciali accorgimenti e delle specifiche competenze richieste nella loro somministrazione agli animali e nelle successive fasi di monitoraggio sui medesimi, sono somministrati soltanto dal medico veterinario.
Art. 7. Riassunto delle caratteristiche del prodotto, etichettatura e foglietto illustrativo
1. Il Ministero della salute approva, ai sensi degli articoli 10, 11, 12, 13, 14 e 35 del regolamento, il riassunto delle caratteristiche del prodotto e le informazioni sull'etichettatura e sul foglietto illustrativo redatti e aggiornati in lingua italiana.
2. I medicinali veterinari possono essere etichettati in diverse lingue oltre alla lingua italiana. In tal caso, il titolare dell'autorizzazione all'immissione in commercio si assume la responsabilità di garantire che le informazioni riportate sull'etichetta dello stesso medicinale in un'altra lingua siano conformi a quanto autorizzato nello Stato membro interessato.
3. Sul confezionamento dei medicinali veterinari autorizzati o registrati per il mercato italiano è aggiunto un codice di identificazione, le cui specifiche sono indicate nell'allegato II del presente decreto.
4. Il titolare dell'autorizzazione all'immissione in commercio di un medicinale veterinario che intende chiedere l'autorizzazione di confezioni multiple frazionabili deve prevedere che le stesse contengano un numero di foglietti illustrativi pari al numero di frazioni dispensabili singolarmente o altro supporto elettronico fruibile per ogni singola frazione.
Art. 8. Autorizzazione all'immissione in commercio di medicinali veterinari per animali tenuti esclusivamente come animali da compagnia
1. La domanda di autorizzazione all'immissione in commercio dei medicinali veterinari per gli animali di cui all'articolo 5, paragrafo 6, del regolamento, contiene:
a) le informazioni di cui all'allegato I del regolamento;
b) la documentazione tecnica di cui all'allegato III del presente decreto;
c) una sintesi del fascicolo di riferimento del sistema di farmacovigilanza.
2. Il Ministero della salute può attribuire la classificazione senza obbligo di prescrizione ai medicinali veterinari la cui domanda di autorizzazione all' immissione in commercio è presentata ai sensi del comma 1.
3. I medicinali veterinari destinati alle specie animali di cui all'articolo 5, paragrafo 6, del regolamento, devono avere confezioni di dimensioni idonee a coprire un ciclo di terapia e per un trattamento individuale o per un ristretto numero di animali.
4. Sono esclusi dal campo di applicazione di cui all'articolo 5, paragrafo 6, del regolamento, i medicinali veterinari contenenti sostanze antimicrobiche.
Capo III
Disposizioni relative ai medicinali omeopatici
Art. 9. Registrazione dei medicinali veterinari omeopatici
1. La domanda di registrazione di un medicinale veterinario omeopatico di cui all'articolo 86 del regolamento, è presentata al Ministero della salute completa della documentazione di cui all'articolo 87, paragrafo 1, del regolamento.
2. Ai fini della registrazione, il Ministero della salute verifica la sussistenza delle condizioni di cui all'articolo 86, paragrafo 1, del regolamento, e procede alla registrazione ovvero alla comunicazione del rigetto della domanda di cui al comma 1, secondo le modalità e i termini previsti dall'articolo 87 del regolamento.
3. Il Ministero della salute classifica, ai sensi dell'articolo 6 del presente decreto, il medicinale veterinario omeopatico registrato.
4. Le modifiche del fascicolo di registrazione dei medicinali veterinari omeopatici che incidono sui documenti di cui all'articolo 87, paragrafo 1, lettere a), b), c) e d), del regolamento, comportano la presentazione di una nuova domanda di registrazione.
5. Fatto salvo quanto previsto dal comma 4, ogni modifica, comprese le integrazioni alla registrazione per nuove confezioni, deve essere comunicata al Ministero della salute almeno trenta giorni prima di essere apportata al fine di consentire le opportune valutazioni e modifiche della registrazione.
Art. 10. Impiego dei medicinali omeopatici ad uso umano
1. In assenza di disponibilità di medicinali veterinari omeopatici registrati, ove la scelta terapeutica è indirizzata all'impiego di medicinali omeopatici, può essere prescritto un medicinale omeopatico registrato per uso umano.
2. Il tempo di attesa di cui all'articolo 4, punto 34), del regolamento, è fissato a zero giorni se il medicinale di cui al comma 1, somministrato a un animale destinato alla produzione di alimenti, è conforme ai requisiti di cui all'articolo 86, paragrafo 1, del regolamento, e le sostanze attive presenti nel medicinale figurano nella Tabella 1 dell'allegato al
Capo IV
Farmacovigilanza
Art. 11. Sistema nazionale di farmacovigilanza
1. Il sistema nazionale di farmacovigilanza è interconnesso e integrato con il sistema di farmacovigilanza dell'Unione di cui al capo IV, sezione 5, del regolamento, in modo da garantire il completo svolgimento delle attività di farmacovigilanza relative alla sicurezza e all'efficacia e consentire una valutazione continua del rapporto beneficio/rischio dei medicinali veterinari autorizzati o registrati nonchè dei mangimi medicati e dei prodotti intermedi di cui al
2. Il sistema nazionale di farmacovigilanza è gestito, ognuno per gli aspetti di competenza, dal Ministero della salute, che svolge anche le funzioni di coordinamento, dalle regioni e dalle Province autonome di Trento e di Bolzano.
Art. 12. Compiti e funzioni delle autorità competenti nel Sistema nazionale di farmacovigilanza
1. Il Ministero della salute:
a) adotta congiuntamente alle regioni e alle Province autonome di Trento e di Bolzano, misure volte a promuovere le segnalazioni di sospetti eventi avversi di cui all'articolo 73, paragrafo 2, del regolamento, che possono essere segnalati da chiunque ne abbia avuto una conoscenza diretta;
b) rende pubbliche, sul proprio sito web, le informazioni di cui all'articolo 79, paragrafo 3, del regolamento;
c) promuove e coordina, anche in collaborazione con l'Istituto superiore di sanità e gli Istituti zooprofilattici sperimentali, studi e ricerche sull'impiego dei medicinali, sull'epidemiologia e predispone piani di prelievo dal circuito distributivo di campioni di medicinali veterinari autorizzati per l'esecuzione di controlli ordinari e straordinari.
2. Le regioni e le Province autonome di Trento e di Bolzano, fatti salvi gli ulteriori compiti dalle stesse eventualmente individuati, nell'ambito delle loro competenze assicurano:
a) la formazione dei medici veterinari e di altri professionisti del settore sanitario;
b) l'esame delle segnalazioni di sospetti eventi avversi pervenute attraverso il sistema nazionale di farmacovigilanza, ai sensi dell'articolo 76 del regolamento, e l'integrazione con i dati eventualmente mancanti, acquisendo le opportune informazioni dal soggetto che ha effettuato la segnalazione;
c) la predisposizione e l'esecuzione di esami di laboratorio clinici e anatomo-istopatologici e, se necessarie, le valutazioni epidemiologiche per la valutazione dell'evento avverso;
d) la trasmissione della segnalazione validata, entro quindici giorni dalla ricezione, attraverso il sistema nazionale di farmacovigilanza al Ministero della salute, affinchè venga registrata nella banca dati di farmacovigilanza dell'Unione entro i termini di cui articolo 76, paragrafo 1, del regolamento;
e) la diffusione delle informazioni al personale sanitario nel settore della farmacovigilanza e alle autorità territorialmente competenti, secondo le indicazioni del Ministero della salute, ove emergano rischi per la salute pubblica, per la salute degli animali o per l'ambiente.
3. Per le attività di farmacovigilanza di cui al comma 2, le regioni e le Province autonome di Trento e di Bolzano possono istituire, nell'ambito degli stanziamenti di bilancio loro assegnati, centri regionali o pluriregionali di farmacovigilanza e possono avvalersi delle autorità territorialmente competenti, degli Istituti zooprofilattici sperimentali, delle Università e di altri centri specializzati.
Art. 13. Farmacovigilanza. Segnalazione di sospetti eventi avversi
1. I medici veterinari, i farmacisti e gli altri professionisti del settore sanitario accreditati nel sistema nazionale di farmacovigilanza segnalano senza ritardo ogni sospetto evento avverso derivante dall'utilizzo di un medicinale veterinario, di un mangime medicato o di un prodotto intermedio attraverso il medesimo sistema.
2. Chiunque ha motivo di ritenere che dall'utilizzo di un medicinale veterinario, di un mangime medicato o di un prodotto intermedio sono derivati sospetti eventi avversi, lo può comunicare attraverso il sistema nazionale di farmacovigilanza.
Capo V
Fabbricazione
Art. 14. Autorizzazione alla fabbricazione di medicinali veterinari e certificati di buona pratica di fabbricazione
1. Il Ministero della salute è l'autorità competente a rilasciare i provvedimenti di cui agli articoli 88, paragrafo 1, e 133 del regolamento, ove ricorrano le condizioni ivi previste nonchè all'inserimento delle informazioni relative all'autorizzazione alla fabbricazione nella banca dati della fabbricazione e della distribuzione all'ingrosso di cui all'articolo 91 del regolamento.
2. Il richiedente interessato presenta la domanda di autorizzazione di cui all'articolo 88, paragrafo 1, del regolamento, completa della documentazione di cui all'articolo 89 del regolamento, al Ministero della salute che valuta la sussistenza delle condizioni e dei requisiti indicati nell'articolo 93 del regolamento, secondo le modalità e i termini stabiliti dall'articolo 90 del regolamento. Il Ministero della salute ove ricorrono le condizioni di cui all'articolo 90, paragrafo 5, del regolamento, adotta i corrispondenti provvedimenti di sospensione o revoca.
3. Il richiedente, nell'individuare la persona qualificata responsabile della fabbricazione e del rilascio dei lotti, verifica che il soggetto è in possesso del diploma, a ciclo unico o di laurea magistrale nelle classi di lauree di possibile equiparazione ai sensi dell'articolo 17, comma 95, lettera a), della
4. Il Ministero della salute è l'autorità competente alla emissione dei certificati di buona pratica di fabbricazione di cui all'articolo 94 del regolamento, nonchè all'inserimento delle relative informazioni nella banca dati della fabbricazione e della distribuzione all'ingrosso disciplinata dall'articolo 91 del regolamento.
Art. 15. Registrazione delle attività di importazione e di fabbricazione delle sostanze attive ad uso veterinario
1. Il Ministero della salute è l'autorità competente a ricevere, secondo le modalità e i termini previsti dall'articolo 95 del regolamento:
a) le richieste dei fabbricanti di sostanze attive stabiliti sul territorio nazionale, di registrazione dell'attività di fabbricazione delle sostanze attive utilizzate come materiali di partenza dei medicinali veterinari;
b) le richieste di registrazione dell'attività di importazione delle sostanze di cui alla lettera a).
2. Il Ministero della salute è l'autorità competente ad adottare i relativi provvedimenti di diniego, di sospensione o di revoca delle registrazioni di cui al comma 1.
3. Gli importatori e i fabbricanti di sostanze attive comunicano al Ministero della salute le modifiche di cui all'articolo 95, paragrafo 5, del regolamento. Il Ministero della salute individua, con proprio provvedimento, le tipologie di modifiche soggette all'obbligo di notifica immediata.
4. Nello svolgimento delle attività di cui ai commi 1 e 2 il Ministero della salute è l'autorità competente all'inserimento delle relative informazioni nella banca dati della fabbricazione e della distribuzione all'ingrosso di cui all'articolo 91 del regolamento.
Capo VI
Sistemi informativi
Art. 16. Sistemi informativi e tracciabilità dei medicinali veterinari
1. Fatto salvo quanto previsto dal regolamento, il Ministero della salute è l'autorità competente ad accedere e operare nella banca dati dei medicinali dell'Unione, nella banca dati di farmacovigilanza dell'Unione nonchè nella banca dati della fabbricazione e della distribuzione all'ingrosso, di cui agli articoli 55, 74 e 91 del regolamento.
2. Il Ministero della salute raccoglie i dati di cui all'articolo 57, paragrafi 1 e 2, del regolamento e li trasmette all'Agenzia europea dei medicinali.
3. I fabbricanti, i depositari, i distributori all'ingrosso, i farmacisti, i titolari degli esercizi commerciali di cui all'articolo 5, comma 1, del
4. I fabbricanti, i depositari, i distributori all'ingrosso, le farmacie, gli esercizi commerciali di cui all'articolo 5, comma 1, del
5. Il titolare dell'autorizzazione all'immissione in commercio comunica, al Ministero della salute, senza indugio, e comunque almeno sessanta giorni prima, la cessazione temporanea della commercializzazione del medicinale veterinario.
6. Ai fini della tracciabilità dei medicinali veterinari, il fabbricante del medicinale veterinario immesso in commercio nel territorio nazionale applica sulle singole confezioni un codice a lettura ottica in conformità a quanto previsto nell'allegato II al presente decreto.
7. Ai fini della tracciabilità, nel caso di medicinale veterinario autorizzato anche in confezioni multiple, ai sensi dell'articolo 7, comma 4, del presente decreto, sul confezionamento della singola frazione sono indicati il numero di lotto e la data di scadenza.
Titolo III
Detenzione, fornitura e impiego dei medicinali veterinari
Art. 17. Autorizzazione alla distribuzione all'ingrosso di medicinali veterinari
1. Le autorità competenti alla adozione del provvedimento di autorizzazione alla distribuzione all'ingrosso dei medicinali veterinari di cui all'articolo 99 del regolamento, sono le regioni e le Province autonome di Trento e di Bolzano per i distributori all'ingrosso stabiliti nel loro territorio.
2. Nella domanda per il rilascio dell'autorizzazione di cui al comma 1, oltre a quanto previsto dall'articolo 100 del regolamento, il richiedente dichiara sotto la propria responsabilità ai sensi del
a) non avere riportato condanne penali per truffa o per commercio di medicinali guasti adulterati o contraffatti;
b) essere iscritto nel registro delle imprese presso la Camera di commercio competente per territorio;
c) disporre di almeno una persona designata come responsabile del magazzino in possesso dei requisiti di cui al comma 3. La responsabilità di più magazzini appartenenti allo stesso titolare può essere affidata a una stessa persona, purchè le attività da questa svolte in ciascun magazzino siano compatibili tra loro;
d) avere implementato le misure di buone pratiche di distribuzione ai sensi del
3. La persona designata di cui al comma 2, lettera c), deve essere in possesso dei seguenti requisiti:
a) diploma di laurea in farmacia o in chimica o in chimica e tecnologia farmaceutiche o in chimica industriale, ai sensi della
b) non aver riportato condanne penali per truffa o per commercio di medicinali guasti, adulterati o contraffatti.
4. La persona designata di cui al comma 2, lettera c), deve svolgere la propria attività a carattere continuativo nella sede indicata nell'autorizzazione con un orario compatibile con le necessità derivanti dalle dimensioni dell'attività di distribuzione espletata.
5. Alla domanda per il rilascio dell'autorizzazione di cui al comma 1 è allegata la seguente documentazione:
a) una planimetria dei locali corredata da una relazione descrittiva delle condizioni degli stessi;
b) la dichiarazione ai sensi del
6. Quando l'esercizio dell'attività di distribuzione all'ingrosso è effettuato in più magazzini con sedi diverse, l'autorizzazione di cui al comma 1 deve essere richiesta per ognuno di essi.
7. Il richiedente mette a disposizione dell'autorità competente, ove richiesto, il manuale di qualità o la strategia di documentazione equivalente di cui al capo II del
8. Al fine dell'applicazione del presente decreto viene messo a disposizione delle regioni e delle Province autonome di Trento e di Bolzano, un modello unico nazionale per la presentazione delle notifiche o delle richieste di autorizzazione alla distribuzione all'ingrosso del medicinale veterinario.
Art. 18. Distribuzione all'ingrosso da parte dei titolari delle autorizzazioni all'immissione in commercio
1. I titolari dell'autorizzazione all'immissione in commercio dei medicinali veterinari, per la distribuzione all'ingrosso dei medicinali veterinari di cui sono titolari, possono avvalersi dei depositi di cui all'articolo 19 del presente decreto, o di altri distributori all'ingrosso autorizzati.
Art. 19. Depositari di medicinali veterinari
1. Le disposizioni del presente titolo si applicano anche alle attività di coloro che detengono e distribuiscono all'ingrosso medicinali veterinari sulla base di contratti di deposito stipulati con i titolari dell'autorizzazione all'immissione in commercio dei medicinali veterinari.
Art. 20. Disposizioni specifiche per la fornitura di ossigeno e di altri gas medicinali
1. La fornitura dell'ossigeno autorizzato per l'uso umano e di altri gas medicinali alle strutture di cura degli animali di cui all'articolo 33 del presente decreto, può essere effettuata secondo le disposizioni del
Art. 21. Distribuzione di sostanze attive
1. Fermi restando gli obblighi di cui all'articolo 95 del regolamento, e, ove applicabile, all'articolo 94 del regolamento, i distributori all'ingrosso stabiliti sul territorio nazionale, ai fini della successiva distribuzione o importazione di sostanze attive, registrano la loro attività presso le regioni e le Province autonome di Trento e di Bolzano nonchè presso il Ministero della salute ai fini dell'iscrizione nella banca dati della fabbricazione e della distribuzione all'ingrosso.
2. I distributori all'ingrosso di cui al comma 1, trasmettono annualmente alle regioni, alle Province autonome di Trento e di Bolzano e al Ministero della salute l'elenco delle modifiche di cui all'articolo 95, paragrafo 5, del regolamento. Il distributore all' ingrosso che importa sostanze attive trasmette all'autorità territorialmente competente un elenco dettagliato delle sostanze oggetto dell'importazione, con indicazione della data e del paese di provenienza.
3. Le sostanze farmacologicamente attive possono essere distribuite soltanto a fabbricanti autorizzati o registrati e a grossisti registrati. A tale fine si considera fabbricante anche il farmacista che effettua preparazioni galeniche in farmacia.
4. È vietato somministrare agli animali sostanze attive, se non in forma di medicinali veterinari.
5. Le regioni o le Province autonome di Trento e di Bolzano, nell'ambito delle rispettive competenze, stabiliscono le procedure per la registrazione dell'attività di distribuzione e importazione delle sostanze attive.
Art. 22. Commercio parallelo di medicinali veterinari
1. Il Ministero della salute è l'autorità competente al rilascio dell'autorizzazione al commercio parallelo sul territorio nazionale di medicinali veterinari autorizzati in un altro Stato membro ove sussistano le condizioni di cui all'articolo 102, paragrafo 1, del regolamento.
2. Il distributore all'ingrosso che intende richiedere l'autorizzazione di cui al comma 1, presenta la domanda al Ministero della salute completa, oltre che delle informazioni e della documentazione di cui all'articolo 102, paragrafi 6 e 7, del regolamento, anche delle informazioni e della documentazione di seguito elencate:
a) il nome, o ragione sociale, e il domicilio, o sede legale, del titolare dell'autorizzazione all'immissione in commercio nonchè il domicilio o la sede legale del distributore all'ingrosso nello Stato membro di origine e del distributore all'ingrosso nello Stato membro di destinazione;
b) la denominazione del medicinale veterinario;
c) le confezioni proposte;
d) il testo dell'etichettatura e del foglietto illustrativo proposti;
e) le specie animali di destinazione;
f) l'impegno ad applicare il codice a lettura ottica di cui all'allegato II del presente decreto sulle singole confezioni di medicinali;
g) la dichiarazione di impegno da parte del distributore all'ingrosso a comunicare eventuali variazioni intervenute nel medicinale veterinario autorizzato al commercio parallelo;
h) l'impegno a tenere a disposizione, a favore del Ministero, un campione di ciascun lotto del medicinale veterinario oggetto di commercio parallelo per l'intera validità del lotto stesso;
i) la dichiarazione di accettazione, da parte della persona qualificata del fabbricante, ad effettuare il riconfezionamento del medicinale veterinario oggetto di commercio parallelo.
3. Nel termine di novanta giorni dalla data di presentazione della domanda, il Ministero della salute adotta il provvedimento di autorizzazione, corredato dagli stampati approvati, ovvero adotta il provvedimento di diniego.
4. Il titolare dell'autorizzazione al commercio parallelo comunica al Ministero della salute almeno trenta giorni prima, ogni modifica delle informazioni di cui al comma 2 al fine di consentire allo stesso Ministero le opportune valutazioni.
Art. 23. Vendita al dettaglio e vendita diretta
1. La vendita al dettaglio dei medicinali veterinari è effettuata dal farmacista in farmacia e negli esercizi commerciali di cui all'articolo 5, comma 1, del
2. La vendita diretta dei medicinali veterinari avviene sotto la responsabilità di persona iscritta all'albo dell'Ordine dei farmacisti e previo rilascio dell'autorizzazione di cui al comma 3. Ai fini del presente decreto, per «vendita diretta» si intende:
a) la vendita di medicinali veterinari effettuata dai titolari di autorizzazione alla distribuzione all'ingrosso agli operatori di stabilimenti in cui si allevano e si detengono professionalmente animali, ai direttori sanitari delle strutture di cura degli animali e ai medici veterinari nell'esercizio dell'attività zooiatrica;
b) la vendita di medicinali veterinari senza obbligo di prescrizione effettuata dai titolari di autorizzazione alla distribuzione all'ingrosso;
c) la vendita dei medicinali veterinari autorizzati ai fini della fabbricazione dei mangimi medicati da parte dei fabbricanti, dei titolari di autorizzazione all'immissione in commercio e dei titolari di autorizzazione alla distribuzione all'ingrosso, ai titolari di stabilimenti autorizzati alla produzione di mangimi medicati per autoconsumo ai sensi dell'articolo 13 del
3. L'autorizzazione all'esercizio dell'attività di vendita diretta di medicinali veterinari è rilasciata dalle regioni e dalle Province autonome di Trento e di Bolzano, non oltre novanta giorni dalla data di ricezione dell'istanza da parte dell'ufficio competente a condizione che il richiedente soddisfi i seguenti requisiti:
a) sia in possesso dell'autorizzazione alla distribuzione all'ingrosso di medicinali veterinari, rilasciata ai sensi dell'articolo 99 del regolamento e dell'articolo 17 del presente decreto; tale requisito non è richiesto ai fabbricanti di medicinali veterinari autorizzati ai fini della fabbricazione dei mangimi medicati qualora, in relazione a tali prodotti, siano titolari dell'autorizzazione in commercio;
b) non abbia riportato condanne penali per truffa o per commercio di medicinali guasti, adulterati o contraffatti;
c) disponga di una persona responsabile della vendita diretta iscritta all'albo dell'Ordine dei farmacisti che non abbia riportato condanne penali anche non definitive, per truffa o per commercio di medicinali guasti, adulterati o contraffatti.
4. L'incarico di farmacista responsabile della vendita diretta è incompatibile con la figura di direttore o titolare di farmacia.
5. La responsabilità della vendita diretta in più magazzini appartenenti allo stesso titolare può essere affidata a una stessa persona purchè in ciascun magazzino sia garantita la presenza della persona responsabile di cui al comma 3, lettera c), durante gli orari di vendita.
6. Nel caso in cui l'esercizio dell'attività di vendita diretta di medicinali veterinari sia effettuato in più magazzini con sedi diverse facenti capo a un unico titolare, l'autorizzazione di cui al comma 3, deve essere richiesta per ognuno di essi.
7. L'autorizzazione di cui al comma 3 riporta almeno le generalità del titolare e la sede fisica in cui avviene la vendita diretta.
8. L'autorità competente conserva le seguenti informazioni relative all'autorizzazione:
a) le generalità della persona responsabile della vendita di cui al comma 3, lettera c);
b) i giorni e gli orari di vendita.
9. Ogni modifica delle informazioni riportate nell'autorizzazione è comunicata all'autorità competente che ha rilasciato l'autorizzazione.
10. Le regioni e le Province autonome di Trento e di Bolzano stabiliscono le procedure per il rilascio dell'autorizzazione di cui al presente articolo.
Art. 24. Prescrizioni a carico del titolare dell'autorizzazione alla vendita al dettaglio o diretta
1. I rivenditori al dettaglio di medicinali veterinari si riforniscono di medicinali veterinari soltanto dai titolari di un'autorizzazione alla distribuzione all'ingrosso, dai fabbricanti e dai titolari delle autorizzazioni all'immissione in commercio.
2. Fermo restando il rispetto della normativa nazionale in materia di vendita al dettaglio e gli obblighi di cui all'articolo 103, paragrafi 3 e 5, del regolamento, il titolare dell'autorizzazione alla vendita al dettaglio e alla vendita diretta di medicinali veterinari osserva le seguenti disposizioni:
a) rendere i locali e le attrezzature accessibili in ogni momento al personale incaricato dell'ispezione;
b) avvalersi sia in fase di approvvigionamento, per quanto di competenza, che in fase di distribuzione, di sistemi o di apparecchiature idonee a garantire, secondo i requisiti tecnici previsti dalla Farmacopea ufficiale, la corretta conservazione dei medicinali veterinari, anche durante il trasporto, ove previsto;
c) comunicare preventivamente all'autorità competente che ha rilasciato l'autorizzazione alla vendita diretta qualsiasi modifica dei requisiti e delle condizioni richieste ai fini del rilascio dell'autorizzazione.
Art. 25. Casi particolari di dispensazione dei medicinali veterinari
1. Ferma restando la presenza in commercio di confezioni multiple di medicinali veterinari che contengano un numero di foglietti illustrativi pari al numero di frazioni dispensabili singolarmente, o altro supporto elettronico fruibile per ogni frazione, i farmacisti di cui all'articolo 23, comma 1, del presente decreto, nel rispetto delle norme specifiche per la vendita al dettaglio possono vendere le singole frazioni consegnando il foglietto illustrativo, ove presente, al fine di fornire la quantità minima del medicinale veterinario necessaria al trattamento prescritto.
2. Il farmacista, prima della vendita, informa l'utente della possibilità di utilizzare un medicinale veterinario generico o equivalente, quando questo è economicamente più conveniente o quando il medicinale veterinario prescritto non è disponibile nel canale distributivo.
3. Per le finalità di cui al comma 2, per medicinale veterinario equivalente si intende un medicinale veterinario, diverso da medicinale biologico e immunologico, avente la stessa composizione qualitativa e quantitativa di sostanze attive e la stessa forma farmaceutica del medicinale prescritto, autorizzato per la stessa indicazione con identica posologia per la stessa specie animale oggetto della prescrizione e, nel caso di animali allevati per la produzione di alimenti a uso umano, con gli stessi tempi di attesa.
4. Il Ministero della salute provvede alla pubblicazione e al relativo aggiornamento sul proprio sito istituzionale dell'elenco dei medicinali veterinari di riferimento e dei medicinali generici che sono autorizzati all'immissione in commercio in Italia.
Art. 26. Vendita in altri esercizi commerciali
1. La distribuzione all'ingrosso e la vendita dei medicinali veterinari non soggetti a prescrizione veterinaria di cui all'articolo 5, paragrafo 6, del regolamento, può essere effettuata anche in esercizi commerciali diversi da quelli di cui all'articolo 23 del presente decreto.
2. La vendita al dettaglio dei medicinali veterinari ad azione antiparassitaria e disinfestante per uso esterno e per uso orale può essere effettuata anche in esercizi commerciali diversi da quelli di cui all'articolo 23, purchè non sia previsto obbligo di prescrizione veterinaria.
3. Gli esercizi commerciali di cui al presente articolo si approvvigionano dei predetti medicinali veterinari dai fabbricanti e dai grossisti autorizzati nonchè dai depositari di cui all'articolo 19 o dai titolari di autorizzazione all'immissione in commercio e, nel caso di cui al comma 1, da altri esercizi commerciali diversi da quelli di cui all'articolo 23.
Art. 27. Vendita al dettaglio di medicinali veterinari a distanza
1. È consentita la vendita al dettaglio a distanza dei soli medicinali veterinari non soggetti all'obbligo di prescrizione veterinaria.
2. Fatte salve eventuali disposizioni territoriali in materia, il rivenditore al dettaglio registra la propria attività, secondo quanto previsto dall'articolo 104 del regolamento.
3. La vendita al dettaglio a distanza dei medicinali veterinari è soggetta al rispetto della normativa vigente in materia di vendita al dettaglio di medicinali veterinari nonchè di tutti gli altri obblighi di cui al regolamento e al presente decreto. I soggetti cui agli articoli 23 e 26 del presente decreto, garantiscono il rispetto delle condizioni di conservazione anche durante il trasporto.
4. Al fine di garantire la sicurezza dei medicinali veterinari venduti a distanza al pubblico mediante i servizi della società dell'informazione di cui all'articolo 2, comma 1, lettera a), del
5. Il Ministero della salute indice periodicamente la conferenza di servizi di cui all'articolo 14, comma 1, della
6. Il Ministero della salute, anche a seguito dell'istruttoria della conferenza di servizi di cui al comma 5, dispone, con provvedimento motivato, in via d'urgenza, la cessazione di pratiche commerciali consistenti nell'offerta, attraverso i mezzi della società dell'informazione, di medicinali veterinari, compresi quelli senza obbligo di prescrizione, non conformi ai requisiti previsti dal presente decreto.
7. I provvedimenti di cui ai commi 4 e 6 sono eseguiti dal Comando dei carabinieri per la tutela della salute.
8. I provvedimenti amministrativi di blocco all'accesso dei siti illegali di vendita on line di medicinali veterinari sono pubblicati dal Ministero della salute sul proprio sito istituzionale.
Art. 28. Prescrizione veterinaria
1. La prescrizione veterinaria, che reca gli elementi di cui all'articolo 105, paragrafo 5, del regolamento, è redatta in formato elettronico, tramite il sistema informativo di tracciabilità di cui all'articolo 2, comma 2, lettera b), del presente decreto. Sono fatte salve le disposizioni più restrittive di cui al
2. La validità della prescrizione veterinaria decorre dalla data del rilascio ed è stabilita in:
a) sei mesi per la prescrizione veterinaria ripetibile che può essere utilizzata per un massimo di dieci volte entro tale periodo;
b) trenta giorni per la prescrizione veterinaria non ripetibile, per la prescrizione veterinaria per l'acquisto di scorta di medicinali e per la prescrizione veterinaria di medicinali il cui impiego non è previsto dai termini dell'autorizzazione all'immissione in commercio.
3. Restano ferme le norme sulle prescrizioni di medicinali contenenti sostanze stupefacenti e psicotrope di cui al
Art. 29. Impiego di medicinali antimicrobici
1. Il Ministero della salute, in conformità all'articolo 107, paragrafo 4, del regolamento, fornisce orientamenti sui rischi associati alla metafilassi e sui criteri relativi alla sua applicazione, su alternative adeguate all'impiego per metafilassi di medicinali antimicrobici nonchè sui casi eccezionali di un loro utilizzo per profilassi. I predetti orientamenti sono oggetto di revisione costante alla luce dei nuovi dati scientifici.
2. L'impiego di medicinali antimicrobici per profilassi e metafilassi avviene in osservanza alle disposizioni del regolamento, agli orientamenti forniti dall'autorità competente e alle politiche nazionali sull'impiego prudente degli antimicrobici e deve essere debitamente giustificato e documentato.
3. Fermo restando quanto previsto dall'articolo 107 del regolamento, gli operatori e i medici veterinari, nell'ambito delle loro rispettive responsabilità, tengono conto delle seguenti misure:
a) l'associazione di più di un medicinale veterinario contenente sostanze attive antimicrobiche è consentita soltanto in casi opportunamente giustificati e documentati e per la somministrazione a un singolo animale. Il trattamento di un gruppo ristretto di animali con più di un medicinale veterinario contenente sostanze attive antimicrobiche deve essere opportunamente giustificato sulla base di una diagnosi clinica e di laboratorio, che includa la coltura batterica e il test di sensibilità;
b) gli antibiotici, per cui specifiche raccomandazioni scientifiche dell'Agenzia europea per i medicinali raccomandano una limitazione, sono impiegati, per quanto possibile, sulla base di esami batteriologici e test di sensibilità, per accertarsi che non esistano altri antibiotici sufficientemente efficaci o appropriati per trattare la malattia diagnosticata;
c) gli antibiotici, per cui specifiche raccomandazioni scientifiche dell'Agenzia europea per i medicinali raccomandano una limitazione sono impiegati per metafilassi solo in casi eccezionali, sulla base di esami batteriologici e test di sensibilità, per accertarsi che non esistano altri antibiotici sufficientemente efficaci o appropriati per trattare la malattia diagnosticata, salvo casi particolari, adeguatamente motivati e documentati dal medico veterinario;
d) gli antibiotici, per cui specifiche raccomandazioni scientifiche dell'Agenzia europea per i medicinali raccomandano una limitazione, non sono impiegati per la profilassi;
e) i mangimi medicati contenenti medicinali veterinari antimicrobici non sono utilizzati per la profilassi ai sensi dell'articolo 17, paragrafo 3, del
4. Le regioni e le Province autonome di Trento e di Bolzano, nell'ambito delle proprie competenze, collaborano con il Ministero della salute ai fini del contrasto alla resistenza agli antimicrobici promuovendo corsi di formazione e attività divulgative per operatori e medici veterinari, dandone annualmente comunicazione al Ministero della salute.
5. Per favorire un impiego consapevole degli antimicrobici, le organizzazioni e le associazioni di categoria promuovono corsi di formazione e attività divulgative per i medici veterinari e per gli operatori, dandone annualmente comunicazione al Ministero della salute.
6. Le spese di partecipazione alle attività formative e divulgative di cui ai commi 4 e 5 sono a carico dei medici veterinari e degli operatori.
Art. 30. Impiego di medicinali veterinari non autorizzati in Italia
1. Fatto salvo quanto previsto dal comma 3, il Ministero della salute è l'autorità competente alla adozione del provvedimento di autorizzazione alla importazione di medicinali veterinari autorizzati in Paesi terzi.
2. Il Ministero della salute è l'autorità competente alla adozione al provvedimento di autorizzazione alla introduzione dei medicinali veterinari immunologici per animali destinati alla produzione di alimenti per il consumo umano autorizzati in altri Stati membri.
3. Nel caso di medicinali veterinari di cui all'articolo 112, paragrafo 2, del regolamento, il medico veterinario notifica l'importazione di un medicinale veterinario all'autorità territorialmente competente entro dieci giorni dalla prescrizione veterinaria.
4. Nel caso di impiego di medicinali veterinari immunologici autorizzati in altri Stati membri ai sensi dell'articolo 112, paragrafo 1, lettera a) del regolamento, il medico veterinario notifica l'introduzione di tale medicinale veterinario immunologico all'autorità territorialmente competente entro dieci giorni dalla prescrizione veterinaria.
Titolo IV
Scorte dei medicinali veterinari
Art. 31. Scorte di medicinali
1. L'autorità territorialmente competente, individuata dalle regioni e dalla Province autonome di Trento e di Bolzano, può consentire la detenzione di adeguate scorte di medicinali agli operatori degli stabilimenti presso gli stabilimenti stessi e ai medici veterinari nell'ambito dell'esercizio dell'attività zooiatrica, a condizione che le scorte siano conservate in modo conforme alle condizioni prescritte nell'autorizzazione all'immissione in commercio e custodite in locali resi accessibili alle autorità territorialmente competenti nel corso delle ispezioni e dei controlli di cui all'articolo 123 del regolamento.
2. Le strutture sanitarie dove si curano gli animali, di cui all'articolo 2, comma 1, lettera m), del
3. Il medico veterinario è responsabile della detenzione delle scorte di medicinali e della loro utilizzazione nonchè delle registrazioni di competenza nel sistema informativo della tracciabilità.
4. Con decreto del Ministro della salute, da adottare di intesa con la Conferenza permanente per i rapporti tra lo Stato, le regioni e le Province autonome di Trento e di Bolzano, possono essere individuate ulteriori modalità tecniche e operative per la detenzione delle scorte.
Art. 32. Modalità di tenuta e gestione delle scorte presso gli stabilimenti in cui si allevano e si detengono animali
1. Gli operatori degli stabilimenti dove si allevano o si detengono gli animali comunicano all'autorità territorialmente competente la necessità di detenere scorte di medicinali.
2. L'autorità territorialmente competente consente la detenzione di scorte di medicinali solo agli operatori degli stabilimenti che non hanno riportato condanne penali per le attività di cui al comma 1.
3. La comunicazione di cui al comma 1 individua il medico veterinario responsabile di cui all'articolo 31, comma 3, del presente decreto.
4. Il medico veterinario responsabile delle scorte può affidare i compiti di detenzione, utilizzo e registrazione delle scorte a uno o più medici veterinari che ne assumono la relativa responsabilità. Tale delega deve essere immediatamente notificata all'autorità territorialmente competente, unitamente a una dichiarazione di accettazione dell'incarico e all'indicazione degli ulteriori stabilimenti presso i quali i delegati risultano eventualmente responsabili delle stesse attività.
5. Il medico veterinario responsabile delle scorte negli stabilimenti in cui si allevano e si detengono animali destinati alla produzione di alimenti nonchè i suoi delegati non possono svolgere incarichi di dipendenza o collaborazione con i titolari delle autorizzazioni in commercio, con i fabbricanti, distributori all'ingrosso e con gli operatori del settore dei mangimi o essere dipendenti del Servizio sanitario nazionale.
6. L'autorità territorialmente competente registra nel sistema informativo della tracciabilità le informazioni di cui ai commi 1, 2 e 3, ed effettua, entro i dodici mesi successivi alla data di registrazione, un'ispezione ai sensi dell'articolo 123 del regolamento, per verificare il rispetto dei requisiti di cui al presente articolo e all'articolo 31, comma 1, del presente decreto.
7. Tra gli ulteriori criteri che l'autorità territorialmente competente applica per valutare la necessità di detenere adeguate scorte da parte dei soggetti di cui al comma 1, vi sono:
a) la realtà professionale, quale ad esempio la tipologia e la dimensione dello stabilimento;
b) la situazione geografica.
8. L'operatore di cui al comma 1 garantisce la veridicità delle informazioni trasmesse e le mantiene aggiornate.
9. Le scorte detenute negli stabilimenti in cui si allevano o si detengono gli animali possono essere costituite da medicinali veterinari, medicinali omeopatici, inclusi quelli di cui all'articolo 10 del presente decreto, alle condizioni e nei limiti di cui agli articoli 112, 113 e 114 del regolamento.
10. Non possono essere detenute scorte, nemmeno per un periodo limitato, di medicinali veterinari contenenti antimicrobici per cui specifiche raccomandazioni dell'Agenzia europea dei medicinali raccomandano limitazioni e non possono essere detenute scorte di medicinali veterinari contenenti antimicrobici ai fini della fabbricazione dei mangimi medicati o da somministrarsi, per trattamento non individuale, attraverso gli alimenti liquidi o solidi e acqua di abbeverata, fatta salva la detenzione di quantitativi ridotti di tali medicinali, commisurati alle necessità dell'allevamento, per un periodo non superiore a cinque giorni.
11. L'utilizzo del medicinale della scorta in animali destinati alla produzione di alimenti per il consumo umano può avvenire soltanto dietro specifica procedura informatica da parte del medico veterinario responsabile o del suo delegato, nel rispetto degli obblighi di registrazione di cui all'articolo 108 del regolamento, e secondo le modalità previste dal
12. Il medico veterinario responsabile delle scorte negli stabilimenti in cui si allevano e si detengono animali non destinati alla produzione di alimenti o i suoi delegati effettuano, con cadenza semestrale, un controllo della giacenza delle scorte e aggiornano, entro il quinto giorno del primo mese successivo a ciascun semestre, il sistema informativo della tracciabilità, fatte salve le norme specifiche sulle registrazioni di medicinali contenenti sostanze stupefacenti e psicotrope di cui al
Art. 33. Modalità di tenuta e gestione delle scorte presso le strutture sanitarie di cura degli animali
1. Il direttore sanitario delle strutture di cura degli animali è il medico veterinario responsabile di cui all'articolo 31, comma 3.
2. Il direttore sanitario è altresì responsabile dell'individuazione dei medici veterinari a cui è consentito l'accesso alle scorte nonchè dell'aggiornamento dei loro nominativi nel Sistema informativo nazionale degli animali da compagnia di cui all'articolo 2, lettera z) del
3. Il direttore sanitario e i medici veterinari di cui al comma 2 possono, per interventi professionali urgenti da eseguire fuori dalle strutture, utilizzare i medicinali prelevati dalla scorta.
4. Le scorte detenute nelle strutture di cura degli animali possono essere costituite da medicinali veterinari, da medicinali a uso umano alle condizioni e nei limiti di cui agli articoli 112, 113 e 114 del regolamento e da medicinali omeopatici, inclusi quelli di cui all'articolo 10 del presente decreto.
5. I medicinali a uso umano di cui agli articoli 92, 93 e 94 del
6. I medicinali a uso umano di cui ai commi 4 e 5 non possono essere ceduti ai proprietari e ai detentori degli animali.
7. Le strutture di cura degli animali, in presenza delle condizioni previste dagli articoli 112 e 113 del regolamento, possono detenere ossigeno e altri gas medicinali autorizzati per uso umano.
8. Nel caso di impiego di medicinali in animali destinati alla produzione di alimenti, l'utilizzo dei medicinali può avvenire soltanto dietro specifica indicazione terapeutica informatica da parte del medico veterinario, che ne registra il trattamento nel rispetto degli obblighi di registrazione di cui all'articolo 108 del regolamento e secondo le modalità previste dal
9. Relativamente all'impiego dei medicinali utilizzati per gli animali non destinati alla produzione di alimenti, il direttore sanitario effettua, con cadenza semestrale, un controllo della giacenza delle scorte e aggiorna, entro il quinto giorno del primo mese successivo a ciascun semestre, il sistema informativo della tracciabilità, fatte salve le norme specifiche sulle registrazioni di medicinali contenenti sostanze stupefacenti e psicotrope di cui al
Art. 34. Modalità di tenuta e gestione delle scorte da parte del medico veterinario nell'esercizio dell'attività zooiatrica
1. Il medico veterinario nell'esercizio dell'attività zooiatrica comunica all'autorità territorialmente competente la esigenza di detenere scorte di medicinali.
2. La comunicazione di cui al comma 1 indica l'ubicazione dei locali adibiti alla detenzione delle scorte di cui all'articolo 31, comma 1, del presente decreto, che non può coincidere con una struttura di cura di cui all'articolo 33 del presente decreto.
3. Le scorte possono essere costituite da medicinali veterinari e dai medicinali omeopatici di cui all'articolo 10 del presente decreto.
4. I medicinali a uso umano, inclusi quelli di cui agli articoli 93 e 94 del
5. I medicinali a uso umano di cui al comma 4 non possono essere ceduti ai proprietari e ai detentori degli animali.
6. La modalità di gestione delle scorte da parte del medico veterinario nell'esercizio dell'attività zooiatrica è disciplinata dall'articolo 33 del presente decreto.
Art. 35. Utilizzo dei medicinali negli stabilimenti autorizzati ai sensi dell'articolo 20, comma 2, del
1. Gli stabilimenti autorizzati ai sensi dell'articolo 20, comma 2, del
2. La detenzione e l'utilizzo delle scorte presso gli stabilimenti di cui al comma 1 ricade sotto la responsabilità del medico veterinario designato di cui all'articolo 24 del
3. Il medico veterinario designato può delegare altri soggetti, adeguatamente formati ai sensi dell'articolo 23, comma 2, del
4. Nel caso di assenza di scorta, per la prescrizione di medicinali utilizzati nell'ambito delle procedure di cui all'articolo 3, comma 1, lettera a) del
5. Nei casi di progetti che prevedano l'utilizzo di animali destinati alla produzione di alimenti e per i quali è prevista o si renda necessaria la reintroduzione degli stessi, si stabilisce un adeguato tempo di attesa e si applicano le disposizioni del regolamento nonchè dell'articolo 19 del
Art. 36. Modalità di conservazione e di utilizzo delle rimanenze di medicinali
1. Non costituiscono scorte le rimanenze di medicinali al termine delle terapie prescritte o dovute all'interruzione o alla modifica della terapia prescritta.
2. Ferma restando la corretta gestione dei medicinali scaduti, le rimanenze di cui al comma 1 sono conservate secondo le modalità di conservazione indicate nell'etichettatura del medicinale.
3. I proprietari e i detentori di animali possono utilizzare le rimanenze di cui al comma 1, solo dietro indicazione di un medico veterinario e, nel caso di animali destinati alla produzione di alimenti, di procedura informatica da parte del medico veterinario e nel rispetto degli obblighi di registrazione elettronica di cui all'articolo 108 del regolamento.
4. Le rimanenze di medicinali veterinari autorizzati per animali non destinati alla produzione di alimenti, con l'esclusione dei medicinali veterinari che richiedono conservazione a temperatura controllata o appartenenti alla categoria delle sostanze stupefacenti e psicotrope, possono essere consegnate al medico veterinario responsabile di stabilimenti in cui si detengono animali non destinati alla produzione di alimenti e per cui l'autorità territorialmente competente ha consentito la detenzione di adeguate scorte di medicinali, a condizione che il medicinale veterinario sia correttamente conservato nella sua confezione originale integra.
5. Il medico veterinario responsabile di cui al comma 4 verifica l'integrità del confezionamento, lo stato di conservazione e la validità del medicinale veterinario consegnato, nonchè se esso sia soggetto a restrizioni ai sensi dell'articolo 5, comma 4 del presente decreto e registra entro quarantotto ore il carico delle confezioni ricevute nel sistema informativo della tracciabilità, secondo la specifica funzione.
6. L'utilizzo delle rimanenze di cui al comma 4 avviene solo dietro indicazione del medico veterinario responsabile che effettua, con cadenza semestrale, un controllo delle giacenze delle scorte e aggiorna, entro il quinto giorno del primo mese successivo a ciascun semestre, il sistema informativo della tracciabilità.
Art. 37. Cessione dei medicinali veterinari
1. Il medico veterinario, nell'ambito della propria attività, può consegnare all'allevatore o al proprietario degli animali medicinali veterinari della propria scorta, anche da confezioni multiple in frazioni distribuibili singolarmente, ove disponibili sul mercato, corredate di foglietto illustrativo o altro supporto elettronico fruibile per ogni singola frazione, allo scopo di avviare la terapia prescritta in modo da garantire la tutela immediata del benessere animale.
2. Il medico veterinario di cui al comma 1, fatti salvi gli obblighi di registrazione posti a carico dei proprietari e detentori di animali destinati alla produzione di alimenti ai sensi dell'articolo 108 del regolamento, registra, entro sette giorni, lo scarico delle confezioni o delle frazioni consegnate nel sistema informativo della tracciabilità, secondo la specifica funzione.
Titolo V
Pubblicità
Art. 38. Pubblicità dei medicinali veterinari
1. La pubblicità dei medicinali veterinari si attua conformemente a quanto previsto negli articoli 119, 120 e 121 del regolamento, con le modalità indicate nell'allegato V del presente decreto.
2. I medicinali veterinari autorizzati o registrati non soggetti a obbligo di prescrizione veterinaria possono essere oggetto di pubblicità nei confronti della generalità delle persone diverse da quelle indicate nell'articolo 120 del regolamento, secondo le modalità e le condizioni di cui all'articolo 119 del regolamento, previo rilascio dell'autorizzazione da parte del Ministero della salute secondo la procedura definita nell'allegato V del presente decreto.
3. È vietata la distribuzione al pubblico di medicinali veterinari a scopo pubblicitario.
4. È vietato menzionare la denominazione di un medicinale veterinario in un contesto che possa favorire il consumo del prodotto in pubblicazioni a stampa, trasmissioni radio-televisive e in messaggi non a carattere pubblicitario comunque diffusi al pubblico.
5. Qualora la pubblicità di cui al comma 2 del presente articolo sia effettuata in violazione alle disposizioni del regolamento e del presente decreto, il Ministero della salute:
a) ordina l'immediata cessazione della pubblicità;
b) ordina la diffusione, a spese del trasgressore, di un comunicato di rettifica e di precisazione, secondo modalità stabilite dallo stesso Ministero, ove non ritenga di provvedere ai sensi dell'articolo 7 della
6. Fermo restando quanto disciplinato nel presente decreto, il Ministro della salute provvede a disciplinare, previa intesa con la Conferenza permanente per i rapporti tra lo Stato, le regioni e le Province autonome di Trento e di Bolzano, sentite le associazioni di categoria, l'ambito di applicazione e le modalità di realizzazione della pubblicità dei medicinali veterinari soggetti a prescrizione veterinaria, di cui all'articolo 120 del regolamento.
7. Fatte salve le competenze in materia delle regioni e delle Province autonome di Trento e di Bolzano, qualora la pubblicità cui all'articolo 120 del regolamento sia effettuata in violazione delle disposizioni del regolamento e del presente decreto nonchè dei criteri previsti dal Ministero della salute, quest'ultimo:
a) ordina l'immediata cessazione o sospensione dell'informazione promozionale;
b) ordina la diffusione, a spese del trasgressore, di una comunicazione di rettifica e di precisazione, redatta secondo le modalità stabilite dal Ministero della salute che potrà essere inserita sul sito internet istituzionale dello stesso Ministero o anche su quotidiani a tiratura nazionale e riviste scientifiche di settore.
Art. 39. Pubblicità di medicinali veterinari immunologici
1. I medicinali veterinari immunologici possono essere oggetto di pubblicità rivolta anche ad allevatori professionisti conformemente all'articolo 120, paragrafo 2, del regolamento.
2. Non rientrano nell'ambito di applicazione del presente articolo gli allevamenti di tipo familiare, come definiti dall'articolo 2, comma 1, lettera f) del
3. È vietata la pubblicità dei medicinali veterinari immunologici destinati a essere impiegati per prevenire l'estendersi di epidemie o zoonosi, per le quali il Ministro della salute determina l'utilizzo di specifici medicinali veterinari immunologici.
4. È vietato fornire informazioni circa sperimentazioni in atto con il medicinale veterinario immunologico verso malattie sostenute da batteri, virus o loro ceppi per i quali il medicinale veterinario immunologico non risulti ancora autorizzato.
5. È vietato consegnare campioni di medicinali veterinari immunologici a scopo pubblicitario ad allevatori professionisti.
6. È vietata la pubblicità dei medicinali veterinari immunologici attraverso le vie di diffusione massiva.
Art. 40. Campioni gratuiti
1. Fermo restando quanto previsto dall'articolo 119, paragrafi 8, 9 e 10, del regolamento, i campioni gratuiti di medicinali veterinari possono essere consegnati dal titolare dell'autorizzazione all'immissione in commercio, previa compilazione di opportuna documentazione di scarico che attesti l'avvenuta consegna, esclusivamente a un medico veterinario iscritto all'albo professionale. L'impiego dei campioni gratuiti negli animali destinati alla produzione di alimenti è soggetto alle disposizioni di cui all'articolo 108 del regolamento.
2. Ogni campione deve avere le seguenti caratteristiche:
a) graficamente identico alla confezione più piccola messa in commercio;
b) il contenuto può essere inferiore, in numero di unità posologiche o in volume, a quello della più piccola confezione autorizzata all'immissione in commercio;
c) la non corrispondenza del contenuto e, eventualmente, del confezionamento primario della confezione autorizzata è espressamente richiamato in etichetta;
d) il campione è consegnato unitamente al riassunto delle caratteristiche del prodotto;
e) l'etichettatura reca la dicitura: «Campione gratuito - vietata la vendita».
3. Non può essere fornito alcun campione dei medicinali stupefacenti disciplinati dal
4. Il titolare dell'autorizzazione all'immissione in commercio può consegnare ogni anno a ciascun medico veterinario sino a dieci campioni di medicinali veterinari per ogni concentrazione o dosaggio e per ogni forma farmaceutica di un medicinale veterinario esclusivamente nei trentasei mesi successivi alla data di prima commercializzazione del prodotto.
5. Fermo restando quanto disposto dal comma 4, possono essere consegnati ogni anno al medico veterinario sino a dieci campioni di medicinali veterinari nell'ambito del listino aziendale dei medicinali veterinari in commercio da più di trentasei mesi.
6. Con decreto del Ministro della salute possono essere definite ulteriori condizioni relative alla consegna e utilizzazione dei campioni gratuiti di medicinali veterinari anche in riferimento all'attività di informazione medico-scientifica.
Titolo VI
Controlli e sanzioni
Art. 41. Controlli e ispezioni
1. Il Ministero della salute è l'autorità competente a programmare ed eseguire i controlli e le ispezioni di cui agli articoli 123 e 126 del regolamento, fatto salvo quanto disposto al comma 2.
2. Le regioni e le Province autonome di Trento e di Bolzano, anche attraverso i servizi veterinari delle autorità territorialmente competenti, sono le autorità competenti a programmare, su indirizzo del Ministero della salute, ed eseguire i controlli e le ispezioni di cui all'articolo 123, paragrafo 1, lettera a), del regolamento, esclusi i controlli e le ispezioni nei confronti di fabbricanti di medicinali e sostanze attive che rientrano nella competenza del Ministero della salute nonchè le ispezioni e controlli di cui all'articolo 123, paragrafo 1, lettere b), d), e), f), g) e j) del regolamento.
3. I controlli di cui al presente articolo sono eseguiti secondo i principi, i criteri e le modalità di cui al
4. Le spese relative ai controlli e alle ispezioni di cui all'articolo 123, paragrafi 2 e 6, del regolamento di competenza del Ministero della salute, calcolate tenendo conto delle spese di missione del personale, sono poste a carico dei soggetti nei confronti dei quali sono effettuati i controlli e le ispezioni. Dette somme sono riassegnate al Ministero della salute per la copertura delle spese sostenute per tali attività.
5. Al personale incaricato di svolgere l'attività ispettiva presso i siti di fabbricazione dei medicinali veterinari e delle sostanze farmacologicamente attive è corrisposto il medesimo compenso previsto per il personale incaricato di svolgere gli accertamenti tecnici presso i siti di produzione dei medicinali per uso umano. Il compenso di cui al presente comma è a carico dei soggetti nell'interesse dei quali è effettuata l'attività ispettiva ed è corrisposto secondo le modalità di cui al comma 4.
Art. 42. Sanzioni
1. Salvo che il fatto costituisca reato, chiunque immette in commercio medicinali veterinari senza l'autorizzazione o la registrazione rilasciate ai sensi dell'articolo 5 del regolamento nonchè dell'articolo 5, comma 1 e dell'articolo 9, comma 1, del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione.
2. Salvo che il fatto costituisca reato, il titolare di un'autorizzazione all'immissione in commercio di medicinali veterinari che commercializza medicinali veterinari non conformi all'autorizzazione rilasciata ai sensi dell'articolo 5 del presente decreto è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione.
3. Salvo che il fatto costituisca reato, chiunque non osserva i provvedimenti di restrizione temporanea, di modifica, di sospensione o di revoca dell'autorizzazione all'immissione in commercio adottati ai sensi degli articoli 129 e 130 del regolamento e dell'articolo 5, comma 4, del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 15.500 a euro 93.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione o del profitto derivante dalla prosecuzione dell'attività.
4. Salvo che il fatto costituisca reato, chiunque viola il divieto di fornitura di medicinali veterinari nei casi previsti dall'articolo 134 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 15.500 a euro 93.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione.
5. Salvo che il fatto costituisca reato, il titolare della autorizzazione all'immissione in commercio che non rispetta l'obbligo di segnalazione dei sospetti eventi avversi di cui all' articolo 73, paragrafo 2, del regolamento, nonchè gli obblighi inerenti alla farmacovigilanza di cui agli articoli 76, paragrafi 2 e 4, 77, 78, 79, paragrafo 6, 81, paragrafi 1 e 2 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 5.165 a euro 30.990.
6. Salvo che il fatto costituisca reato, i medici veterinari, i farmacisti e gli altri professionisti del settore sanitario accreditati nel sistema nazionale di farmacovigilanza che non rispettano l'obbligo di segnalazione dei sospetti eventi avversi di cui all'articolo 13, comma 1, sono soggetti al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 10.000.
7. Salvo che il fatto costituisca reato, il titolare di un'autorizzazione all'immissione in commercio di un medicinale veterinario che viola le prescrizioni imposte dalle disposizioni in materia di etichettatura e foglietto illustrativo di cui agli articoli 7, 10, 11, 13, 14 e 35 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
8. Salvo che il fatto costituisca reato, il titolare di una registrazione di un medicinale veterinario omeopatico che non osserva le prescrizioni imposte dalle disposizioni in materia di etichettatura dei medicinali omeopatici stabilite dall'articolo 16 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
9. Salvo che il fatto costituisca reato, il titolare di un'autorizzazione all'immissione in commercio che viola gli obblighi di cui all'articolo 58, paragrafi 2, 3, 4, 5, 6, 9, 10, 11, 12, del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 10.330 a euro 42.000.
10. Salvo che il fatto costituisca reato, chiunque fabbrica o importa medicinali veterinari senza l'autorizzazione prevista dall'articolo 14, commi 1, 2 e 4 del presente decreto, e in violazione di quanto previsto dall'articolo 88, paragrafo 1, del regolamento, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione.
11. Salvo che il fatto costituisca reato, chiunque fabbrica, importa, detiene, cede o commercializza sostanze attive, in violazione delle disposizioni di cui dall'articolo 95 del regolamento, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000. A tale violazione consegue la sanzione amministrativa accessoria della confisca delle sostanze attive oggetto della violazione.
12. Salvo che il fatto costituisca reato, i fabbricanti e gli importatori di medicinali veterinari che non osservano gli obblighi imposti rispettivamente dagli articoli 93, paragrafo 1, e 94, paragrafo 5, del regolamento, sono soggetti al pagamento di una sanzione amministrativa pecuniaria da euro 5.165 a euro 30.990. A tale violazione consegue la sanzione amministrativa accessoria della confisca dei medicinali oggetto della violazione.
13. Salvo che il fatto costituisca reato la persona qualificata di cui all'articolo 97 del regolamento, che non osserva gli obblighi imposti dal medesimo articolo 97, paragrafi 6, 7 e 8, del regolamento, è soggetta al pagamento di una sanzione amministrativa pecuniaria da euro 5.165 a euro 30.990.
14. Salvo che il fatto costituisca reato, i titolari dell'autorizzazione alla fabbricazione di medicinali veterinari che non comunicano al Ministero della salute le informazioni di cui all'articolo 14, comma 3, del presente decreto, nonchè i soggetti che richiedono la registrazione delle attività di importazione e di fabbricazione delle sostanze attive a uso veterinario che non osservano l'obbligo di comunicazione di cui all'articolo 15, comma 3, del presente decreto, nonchè i distributori all'ingrosso che non trasmettono gli elenchi di cui all'articolo 21, comma 2, del presente decreto, sono soggetti al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
15. Salvo che il fatto costituisca reato, chiunque effettua pubblicità, promuove o distribuisce campioni di medicinali veterinari in violazione delle disposizioni di cui agli articoli 119, 120 e 121 del regolamento, nonchè agli articoli 38, 39 e 40 del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
16. Salvo che il fatto costituisca reato, chiunque detiene e distribuisce all'ingrosso medicinali veterinari senza l'autorizzazione prevista dall'articolo 99, paragrafo 1, del regolamento, e dall'articolo 17, comma 1, del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.990. È soggetto al pagamento della medesima sanzione chiunque detiene e distribuisce all'ingrosso sostanze attive in violazione di quanto previsto dagli articoli 95, paragrafo 1, del regolamento, e dall'articolo 21, comma 1, del presente decreto.
17. Salvo che il fatto costituisca reato, il titolare dell'autorizzazione alla distribuzione all'ingrosso che non osserva gli obblighi di cui all'articolo 101, paragrafi 1, 2, 3, 4, 5, 6 e 8, del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
18. Salvo che il fatto costituisca reato, chiunque effettua la vendita diretta di un medicinale veterinario non rispettando le condizioni previste dall'articolo 23, commi 2, 4, 5 e 6, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000.
19. Salvo che il fatto costituisca reato, chiunque effettua la vendita diretta di un medicinale veterinario non rispettando le condizioni previste dall'articolo 23, comma 9, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 9.000 a euro 55.000.
20. Salvo che il fatto costituisca reato, il titolare dell'autorizzazione alla vendita al dettaglio e alla vendita diretta di medicinali veterinari che non osserva le prescrizioni di cui all'articolo 24, comma 2, lettere a) e c), del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
21. Salvo che il fatto costituisca reato, il titolare dell'autorizzazione alla vendita al dettaglio e alla vendita diretta di medicinali veterinari che non osserva le prescrizioni di cui all'articolo 24, comma 2, lettera b), del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 5.165 a euro 30.990.
22. Salvo che il fatto costituisca reato, chiunque vende al dettaglio o effettua vendita diretta di medicinali veterinari in assenza di prescrizione veterinaria, se prevista come obbligatoria ai sensi dell'articolo 23, comma 1, del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 1.550 a euro 9.300.
23. Salvo che il fatto costituisca reato, chiunque, somministra agli animali medicinali veterinari non autorizzati ai sensi dell'articolo 5, comma 1, del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000. È soggetto alla medesima sanzione chiunque somministra agli animali sostanze attive in violazione di quanto previsto dall'articolo, 21, comma 4, del presente decreto.
24. Salvo che il fatto costituisca reato, chiunque utilizza medicinali veterinari in modo non conforme ai termini dell'autorizzazione all'immissione in commercio di cui all'articolo 106, paragrafo 1, del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 1.550 a euro 9.300.
25. Salvo che il fatto costituisca reato, il medico veterinario che detiene scorte di medicinali in violazione di quanto previsto dagli articoli 32, comma 9, 33, commi 4, 5 e 7, e 34, comma 4, del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
26. Salvo che il fatto costituisca reato, il medico veterinario che non osserva le disposizioni di cui agli articoli 112, 113, 114 e 115 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
27. Salvo che il fatto costituisca reato, il medico veterinario che non osserva le disposizioni in materia di prescrizione veterinaria di cui all'articolo 105, paragrafi 1, 2, 3 e 6, del regolamento, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
28. Salvo che il fatto costituisca reato, chiunque non osserva gli obblighi di cui all'articolo 107, paragrafi 1, 2, 3, 4 e 5, del regolamento, e di cui agli articoli 29, comma 3, e 32, comma 10, del presente decreto, in materia di medicinali veterinari antimicrobici è soggetto al pagamento della sanzione da euro 5.165 a euro 30.990.
29. Salvo che il fatto costituisca reato, i proprietari e i detentori di animali destinati alla produzione di alimenti che violano le disposizioni di cui all'articolo 108, paragrafi 1 e 5, del regolamento, e gli articoli 32, comma 11, 36, comma 3, del presente decreto, sono soggetti al pagamento della sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
30. Salvo che il fatto costituisca reato, il medico veterinario che non osserva le disposizioni di cui all'articolo 37 del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
31. Salvo che il fatto costituisca reato, chiunque non osserva gli obblighi di comunicazione o di registrazione di cui all'articolo 16 del presente decreto, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 2.600 a euro 15.500.
32. Salvo che il fatto costituisca reato, chiunque violando il divieto stabilito dall'articolo 9, paragrafo 2, del regolamento, destina al consumo umano prodotti alimentari provenienti da animali sottoposti alla sperimentazione di medicinali senza la prescritta autorizzazione è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 10.330 a euro 62.000.
33. Salvo che il fatto costituisca reato, gli operatori degli stabilimenti e i medici veterinari nell'ambito dell'esercizio dell'attività zooiatrica che non osservano gli obblighi di cui all'articolo 31, comma 1, del presente decreto, sono soggetti al pagamento di una sanzione amministrativa pecuniaria da euro 1.550 a euro 9.300.
34. Salvo che il fatto costituisca reato chiunque non osserva gli obblighi di cui agli articoli 32, commi 1, 3 e 4, 33, comma 2, 34, commi 1 e 2, 35, commi 3 e 5, del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 1.550 a euro 9.300.
35. Salvo che il fatto costituisca reato, il medico veterinario che cede ai proprietari o ai detentori di animali i medicinali a uso umano, di cui agli articoli 33, comma 6, e 34, comma 5, del presente decreto, è soggetto al pagamento della sanzione amministrativa pecuniaria da euro 8.000 a euro 50.000.
36. In caso di mancata ottemperanza ai provvedimenti di cui all'articolo 27, commi 4 e 6, del presente decreto, entro il termine indicato nei medesimi provvedimenti, si applica la sanzione amministrativa pecuniaria da euro 15.500 a euro 93.000.
37. Salvo che il fatto costituisca reato, chiunque introduce da altro Stato Membro o importa nell'Unione medicinali veterinari non osservando gli obblighi previsti dall'articolo 30 del presente decreto, nei casi di cui agli articoli 110, paragrafi 1, 2 e 3, e 116 del regolamento, è soggetto al pagamento di una sanzione amministrativa pecuniaria da euro 3.000 a euro 18.000.
38. Il Ministero della salute, le regioni, le Province autonome di Trento e di Bolzano e le aziende sanitarie locali, nell'ambito delle rispettive competenze, provvedono all'accertamento e alla contestazione delle violazioni e all'applicazione delle sanzioni amministrative, secondo le modalità previste dalla
39. I proventi derivanti dalla riscossione delle sanzioni amministrative pecuniarie di spettanza statale, irrogate per le violazioni del presente decreto, affluiscono all'entrata del bilancio dello Stato e restano acquisiti all'erario, ad eccezione di quelli derivanti dall'irrogazione di sanzioni comminate per le violazioni cui ai commi 24, 25, 28, 31 e 35 che, ove di spettanza statale, previo versamento ad apposito capitolo dell'entrata del bilancio dello Stato, sono riassegnati a un apposito capitolo dello stato di previsione della spesa del Ministero della salute per il miglioramento dell'efficienza e dell'efficacia delle attività di controllo e di vigilanza del Ministero della salute.
40. Il Ministro dell'economia e delle finanze è autorizzato ad apportare, con propri decreti, le occorrenti variazioni di bilancio.
Titolo VII
Disposizioni finali
Art. 43. Disposizioni tariffarie
1. Per le attività di valutazione concernenti l'ottenimento e il mantenimento di un'autorizzazione all'immissione in commercio dei medicinali veterinari rilasciata ai sensi del presente decreto sono dovute al Ministero della salute tariffe di importo pari a un decimo degli importi stabiliti dall'articolo 5 del
2. Con decreto del Ministro della salute, di concerto con il Ministro dell'economia e delle finanze, adottato entro dodici mesi dalla data di entrata in vigore del presente decreto, si provvede ai sensi dell'articolo 30, commi 4 e 5, della
3. Nella definizione delle tariffe di cui al comma 2 si tiene conto di quanto previsto nel
4. Ai fini del versamento delle tariffe di cui ai commi 1 e 2, il Ministero della salute può consentire il ricorso al criterio del «conto a scalare» secondo i criteri applicativi definiti dall'articolo 12 del
5. Gli oneri derivanti dall'espletamento delle attività e dagli adempimenti effettivamente svolti ai fini del rilascio e della modifica dei provvedimenti autorizzativi previsti dal regolamento e dal presente decreto, ivi compresi quelli di cui all'articolo 8 del presente decreto nonchè quelli derivanti dalle attività ispettive sia antecedenti che successive al rilascio dei provvedimenti stessi, comprese le spese derivanti da esami e controlli svolti da laboratori nei casi previsti dalle norme del regolamento e del presente decreto, sono a carico dei soggetti nei cui confronti viene svolta l'attività.
6. L'importo delle tariffe di cui ai commi 1, 2 e 5 è dovuto dai soggetti nei confronti dei quali è svolta l'attività e deve in ogni caso coprire il costo del servizio. L'attestazione dell'avvenuto pagamento deve essere allegata alla domanda.
7. Le entrate derivanti dalle tariffe riscosse spettanti al Ministero della salute, di cui ai commi 1, 2 e 5, affluiscono all'entrata del bilancio dello Stato per essere riassegnate, con decreto del Ministro dell'economia e delle finanze, ad appositi capitoli dello stato di previsione della spesa del Ministero della salute ai fini della copertura delle spese sostenute per le attività per le quali le tariffe sono versate.
8. In attuazione del
9. Le somme erogate dall'Agenzia europea per i medicinali a favore del Ministero della salute relative alle prestazioni previste dai contratti di cui al comma 8, affluiscono al pertinente capitolo dello stato di previsione delle entrate per essere riassegnate ad apposito capitolo dello stato di previsione del Ministero della salute e sono utilizzate per far fronte alle spese di missione in Italia e all'estero degli esperti italiani e stranieri che operano nel quadro delle attività previste nei contratti di cui al comma 8, nonchè ai compensi per prestazioni professionali rese sulla base di specifici accordi.
10. Le regioni e le Province autonome di Trento e di Bolzano nonchè le autorità territorialmente competenti provvedono all'esecuzione degli adempimenti di competenza con spese a carico dei richiedenti secondo modalità e tariffe definite sulla base del costo effettivo del servizio in conformità a quanto previsto dal
11. Il Ministro dell'economia e delle finanze è autorizzato ad apportare, con propri decreti, le occorrenti variazioni di bilancio.
Art. 44. Abrogazioni
1. Dalla data di entrata in vigore del presente decreto è abrogato il
Art. 45. Disposizioni transitorie e finali
1. Ai sensi dell'allegato II, punto 4, del regolamento, restano ferme le norme in vigore che disciplinano le buone prassi di fabbricazione dei medicinali veterinari adottate a norma dell'articolo 11, comma 3, del
2. Dalla data di entrata in vigore del presente decreto le disposizioni di cui all'articolo 167 del testo unico delle leggi sanitarie, approvato con
3. Gli allegati al presente decreto, ai sensi dell'articolo 36 della
Art. 46. Clausola di invarianza finanziaria
1. Dalla attuazione del presente decreto non devono derivare nuovi o maggiori oneri, nè minori entrate a carico della finanza pubblica.
2. Le amministrazioni interessate svolgono le attività previste dal presente decreto con le risorse umane, finanziarie e strumentali disponibili a legislazione vigente.
Allegato I
(articolo 6, comma 3)
Tipologie di medicinali veterinari la cui somministrazione deve essere effettuata soltanto dal medico veterinario.
1. Oltre a quelli stabiliti per i trattamenti terapeutici e zootecnici di cui rispettivamente agli articoli 4 e 5 del
a) abortivi, nel caso in cui vengano somministrati con finalità abortive;
b) anestetici locali iniettabili;
c) anestetici generali iniettabili e inalatori;
d) alfa-agonisti usati durante l'anestesia e la pre-anestesia;
e) anticoncezionali iniettabili;
f) antineoplastici iniettabili, citochine e immunomodulatori iniettabili;
g) medicinali veterinari nei casi di uso intrarticolare;
h) emoderivati;
i) eutanasici;
l) beta-agonisti.
2. L'approvvigionamento e la detenzione dei medicinali di cui alle lettere c) e i) del punto 1 del presente allegato, sono consentiti esclusivamente al medico veterinario.
Allegato II
(articolo 7, comma 3)
Modalità di impiego del codice a lettura ottica di identificazione sulle singole confezioni dei medicinali veterinari immessi in commercio.
1. Il codice a lettura ottica applicato dal fabbricante sulle singole confezioni di medicinali veterinari immesse in commercio riporta almeno le seguenti informazioni:
a) identificazione precisa del medicinale veterinario;
b) data di scadenza;
c) numero del lotto di fabbricazione.
2. Il codice a lettura ottica è stampato direttamente sulla confezione del medicinale veterinario o applicato con adesivo non rimovibile.
Le confezioni prive del suddetto codice o non conformi alle prescrizioni di cui al punto 4 non sono ammesse nel canale distributivo. Resta fermo l'obbligo previsto dagli articoli 10, 11 e 12 del regolamento di indicare su ogni singola confezione del medicinale veterinario il numero dell'autorizzazione all'immissione in commercio, di seguito denominata A.I.C., il numero di lotto di fabbricazione e la data di scadenza, ove pertinenti.
3. Il fabbricante applica i codici a lettura ottica soltanto sul confezionamento esterno, se presente, oppure sul confezionamento primario.
4. Specifiche tecniche del codice a lettura ottica di identificazione
a) Codice dell'A.I.C. della confezione del medicinale veterinario.
Il codice A.I.C. stampato direttamente sulla confezione è numerico ed è composto da otto cifre precedute dalla cifra 1.
b) Collegamento tra Global Trade Item Number (GTIN) e A.I.C.
È consentito alla ditta interessata inserire nel codice a lettura ottica quale identificativo della confezione il GS i OTIN (Global Trade Item Number in HEALTHCARE o il numero di autorizzazione all'immissione in commercio attribuito dal Ministero della salute (A.I.C.).
Qualora il numero dell'A.I.C. non sia stato contenuto nel codice a lettura ottica e la ditta interessata identifichi il medicinale veterinario attraverso il GTIN, la stessa provvede, per i medicinali già autorizzati, a comunicare al Ministero della salute il GTIN corrispondente a ciascuna A.I.C. già rilasciata alla data di entrata in vigore del presente allegato; per le nuove richieste di A.I.C. e per la variazioni riguardanti i medicinali già utorizzati, la ditta interessata provvederà a comunicare al Ministero della salute il GTIN al momento della presentazione della richiesta o degli atti definitivi.
Il Ministero della salute rende pubblico il numero di A.I.C. ed i corrispondenti numeri GTIN.
c) Specifiche e standard del codice a lettura ottica.
È consentito alla ditta interessata utilizzare una tra le rappresentazioni elencate alle lettere a) e b):
a) Rappresentazione lineare del codice a lettura ottica contenente le informazioni di cui al punto 1:
standard: GS 1 System;
simbologia: GS1-128;
sintassi: GS1-128;
identificatore univoco articolo: GTIN (Global Trade Item Number);
dati variabili: data scadenza, numero lotto (codificati con il sistema di riferimento GS1-128.
b) Rappresentazione bidimensionale del codice a lettura ottica contenente le informazioni di cui al paragrafo 1:
standard: GS1 Datamatrix-GS1 System;
simbologia: Datamatrix ECC-200 (norma JSO/JEC16022 - Information technology - Internationai Symbology Specification-Data Matrix);
sintassi: GS1-128;
identificatore univoco articolo: GT1N (Global Trade Item Number);
dati variabili: data scadenza, numero lotto (codificati con il sistema di riferimento GS1-128).
Allegato III
(articolo 8, comma 1, lettera b))
Documentazione tecnica da allegare alla domanda di autorizzazione semplificata dei medicinali veterinari destinati a essere utilizzati per gli animali tenuti esclusivamente come animali da compagnia, quali: animali d'acquario o di stagno, pesci ornamentali, uccelli domestici, piccioni viaggiatori, animali da terrario, piccoli roditori, furetti e conigli di cui all'articolo 5, paragrafo 6, del regolamento.
Introduzione.
Un animale da compagnia è un animale detenuto dall'uomo appartenente alle specie elencate nell'allegato I del
L'articolo 5, paragrafo 6, del
Il problema della disponibilità di medicinali veterinari di cui all'articolo 5, paragrafo 6, è simile a quello che si è già posto per le specie minori per cui sono previste semplificazioni ai sensi dell'articolo 23 del regolamento e per le quali sono state adottate specifiche linee guida, che definiscono i contenuti della documentazione scientifica necessaria per la dimostrazione della qualità, sicurezza ed efficacia dei medicinali veterinari ad esse destinati.
Alla luce delle considerazioni sopraesposte e di quanto stabilito nell'articolo 5, paragrafo 6, si definisce la procedura di autorizzazione dei medicinali veterinari mediante la presentazione di un dossier semplificato (documentazione a supporto della registrazione), senza compromettere i principi di tutela della sanità pubblica.
Data la varietà di specie animali (rettili, pesci, uccelli, mammiferi) è estremamente difficile definire a priori requisiti del dossier validi per tutte le casistiche. I criteri definiti in questo documento sono quindi generali.
Il Ministero della salute valuterà, caso per caso, se richiedere documentazioni supplementari rispetto a quanto previsto di seguito all'interno del documento.
Un medicinale veterinario autorizzato ai sensi dell'articolo 5, paragrafo 6, del regolamento è destinato esclusivamente a animali d'acquario o da stagno, pesci ornamentali, uccelli domestici, piccioni viaggiatori, animali da terrario, piccoli roditori, furetti e conigli tenuti esclusivamente come animali da compagnia.
Le indicazioni di tali medicinali veterinari non possono essere estese ad altre specie animali e gli stessi non possono essere usati in deroga, secondo quanto previsto dell'articolo 2, paragrafo 4, del regolamento.
Le domande di AIC per un medicinale destinato alle specie animali di cui all'articolo 5, paragrafo 6, del regolamento seguono le stesse procedure adottate per l'autorizzazione degli altri medicinali veterinari.
Requisiti generali della documentazione da presentare ai fini dell'AIC per medicinali veterinari destinati alle specie animali art. 5, paragrafo 6.
PARTE I - SOMMARIO DEL FASCICOLO.
Informazioni di cui all'allegato I del
PARTE 2 - DOCUMENTAZIONE SULLA QUALITÀ (dati fisico-chimici, biologici o microbiologici).
In generale sono richieste le seguenti informazioni (in conformità alla sezione II - parte 2 - del
2A. composizione qualitativa e quantitativa di tutti i componenti del medicinale e sviluppo del prodotto;
2B. descrizione del metodo di fabbricazione;
2C. produzione e controllo dei materiali di partenza:
sostanze attive;
caratteristiche fisico-chimiche in grado di incidere sulla biodisponibilità;
eccipienti;
confezionamento della sostanza attiva e del prodotto finito.
Per le materie prime di origine animale dimostrare la conformità alla Monografia della Farmacopea: «Minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products (EMA/410/01 rev.3). La conformità può essere dimostrata presentando un certificato di conformità alla monografia pertinente della Farmacopea Europea, rilasciato dalla Direzione Europea per la Qualità dei Medicinali (EDQM);
2D. Prove di controllo effettuate su intermedi isolati durante il processo di fabbricazione;
2E. Prove di controllo del prodotto finito:
a) identificazione e dosaggio delle sostanze attive secondo metodo validato. Profilo delle eventuali impurezze dovute al processo di produzione e dosaggio delle sostanze correlate. Identificazione e dosaggio, degli eccipienti. Il controllo deve essere effettuato su lotti rappresentativi;
b) definizione delle specifiche di rilascio del prodotto finito;
2F. Prove di stabilità:
a) prove di stabilità sulla sostanza attiva e sul prodotto finito in accordo con le linee guida europee;
b) prove di stabilità sul prodotto finito in accordo con le linee guida europee - Prove di stabilità in uso e fotostabilità nel caso di principi attivi fotosensibili.
FABBRICANTE
Deve essere presentato il certificato di buona pratica di fabbricazione ai sensi degli articoli 92, 93, 94 del
PARTE 3 - DOCUMENTAZIONE SULLA SICUREZZA
Le informazioni relative alla sicurezza (farmacologia e tossicologia) per un medicinale veterinario destinato alle specie animali articolo 5, paragrafo 6 del regolamento, sono ridotte e gli studi su animali da laboratorio possono essere sostituiti da quelli sulla specie bersaglio presentati nella Parte 4 della documentazione o da studi validati presenti in letteratura e contenenti relazioni dettagliate.
La documentazione deve contenere una valutazione del rischio per l'utilizzatore e una proposta di gestione del rischio.
In generale sono richieste le seguenti informazioni:
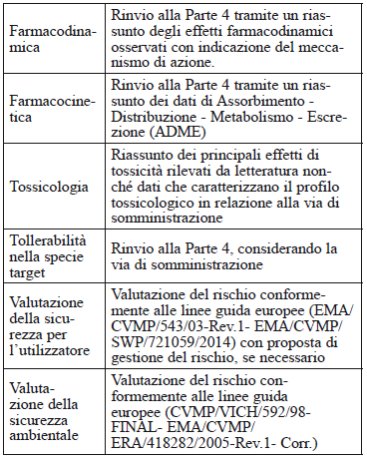
Si evidenzia che, quando il principio attivo contenuto nel medicinale destinato ad un animale da compagnia è stato precedentemente valutato per fissare un limite massimo di residui («LMR») al fine di soddisfare determinati requisiti di sicurezza, a norma del
PARTE 4 - DOCUMENTAZIONE SULL'EFFICACIA
L'efficacia e la sicurezza del prodotto nella specie bersaglio devono essere dimostrate. Il richiedente non è tenuto a fornire i risultati delle prove precliniche o sperimentazioni cliniche, se può dimostrare che le sostanze presenti nel medicinale veterinario sono di impiego ben consolidato nell'Unione Europea e presentano una riconosciuta efficacia ed un livello accettabile di sicurezza nelle specie di destinazione.
La necessità di effettuare studi specifici sarà valutata caso per caso in relazione alle informazioni disponibili.
In generale sono richieste le seguenti informazioni:
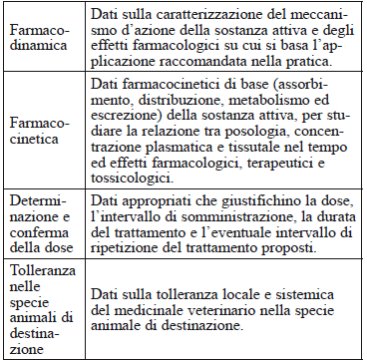
Allegato IV
(articolo 16, comma 3)
IL SISTEMA INFORMATIVO DI TRACCIABILITÀ
(articolo 2, comma 2, lettera b).
Introduzione.
Il sistema informativo di tracciabilità di cui all'articolo 2 comma 2, lettera b) del presente decreto contiene le informazioni relative ai medicinali veterinari autorizzati o registrati a essere immessi in commercio sul territorio italiano, ai medicinali veterinari autorizzati in altro Stato membro o in un Paese Terzo introdotti in conformità agli articoli 112,113,114 e116 del regolamento.
In aggiunta alle informazioni di cui al precedente periodo, il sistema informativo di tracciabilità contiene le informazioni relative:
a formule magistrali e officinali, ai medicinali veterinari immunologici inattivati di cui all'articolo 2, paragrafo 3, del regolamento, ai medicinali autorizzati per l'uso umano prescritti ai sensi degli articoli 112, 113 e 114 del regolamento, limitatamente alle fasi di prescrizione, fornitura e somministrazione dei medicinali a specie animali destinate alla produzione di alimenti;
a mangimi medicati e prodotti intermedi, relativamente alle fasi di prescrizione, produzione per autoconsumo, fornitura e somministrazione a specie animali destinate alla produzione di alimenti.
Il sistema informativo di tracciabilità non contiene le informazioni relative ai trattamenti eseguiti su animali degli allevamenti familiari di cui all'articolo 2, comma 1, lettera f), del
Il Ministero della salute aggiorna e pubblica sul sito istituzionale le modalità applicative delle disposizioni in materia di tracciabilità.
A) Modalità di accesso al sistema informativo di tracciabilità: raccolta e trasmissione dei dati.
1) Il Ministero della salute attribuisce ai fabbricanti, ai depositari, ai distributori all'ingrosso, alle farmacie, agli esercizi commerciali di cui all'articolo 5, comma 1, del
2) I medici veterinari sono identificati attraverso il numero di iscrizione registrato all'albo professionale degli ordini provinciali.
3) I detentori e i proprietari di animali, e i relativi impianti di allevamento e custodia, sono identificati e registrati nella banca dati nazionale (B.D.N.) dell'anagrafe zootecnica del Ministero della salute.
4) Gli operatori del settore dei mangimi registrati o riconosciuti sono iscritti nel Sistema Informativo Nazionale Veterinario per la Sicurezza degli Alimenti (SINVSA).
5) I soggetti di cui ai punti 1, 2, 3 e 4 devono attenersi alle specifiche tecniche di identificazione dei medicinali veterinari, di raccolta, di registrazione e trasmissione delle informazioni previste dal sistema informativo di tracciabilità riportate nel manuale recante le modalità applicative pubblicate sul sito istituzionale del Ministero della salute.
6) Le trasmissioni dei dati avvengono in modalità sicura, secondo le specifiche tecniche riportate nelle modalità applicative pubblicate sul sito istituzionale del Ministero della salute.
7) Le farmacie, ai fini dell'erogazione dei medicinali prescritti con la ricetta veterinaria elettronica, possono utilizzare l'infrastruttura della ricetta elettronica (Sistema di accoglienza centrale-SAC, del Ministero dell'economia e delle finanze ovvero tramite il Sistema di accoglienza regionale- SAR per le Regioni /province autonome che ne sono provviste) di cui al decreto ministeriale 2 novembre 2011, pubblicato nella Gazzetta Ufficiale del 12 novembre 2011, n. 264, nell'ambito del Sistema tessera sanitaria gestito dal Ministero dell'economia e delle finanze. A tale ultimo fine l'infrastruttura SAC, anche tramite il SAR, è interconnessa con il Sistema di tracciabilità secondo le modalità applicative pubblicate sul sito istituzionale del Ministero della salute.
B) Accesso ai dati del sistema informativo della tracciabilità.
1) Il Ministero della salute è titolare del trattamento dei dati del sistema informativo della tracciabilità per le specifiche funzioni istituzionali.
2) Il Ministero dell'economia e delle finanze è responsabile del trattamento dei dati di cui al punto 7) della lettera A) del presente allegato.
3) Sono autorizzate all'accesso al sistema informativo di tracciabilità le regioni e le Province autonome di Trento e di Bolzano, con riferimento ai dati del proprio territorio nonchè le aziende sanitarie locali per le specifiche funzioni istituzionali.
4) Sono previsti diversi livelli di accesso in funzione della necessaria garanzia di riservatezza dei dati comunicati dai soggetti di cui alla lettera A) del presente allegato.
C) Adempimenti dei proprietari e dei detentori degli animali destinati alla produzione di alimenti e dei medici veterinari.
1) Ferma restando la responsabilità nell'adempimento dei rispettivi obblighi, i proprietari e i detentori degli animali destinati alla produzione di alimenti possono farsi assistere nelle attività di inserimento delle registrazioni dei trattamenti da:
a) medici veterinari di cui all'articolo 4, comma 2, del decreto del Ministro della salute 7 dicembre 2017, pubblicato nella Gazzetta Ufficiale n. 29 del 5 febbraio 2018;
b) medici veterinari di cui all'articolo 32 del presente decreto, diversi da quelli previsti dalla lettera a);
c) medici veterinari che hanno emesso la prescrizione veterinaria.
2) I medici veterinari di cui al punto 1) provvedono con immediatezza agli adempimenti informatici cui agli articoli 32, 33, 34 e 36 del presente decreto e correlati alla registrazione dei trattamenti, in modo da consentire il rispetto del termine di quarantotto ore previsto del
D) Adempimenti dei farmacisti operanti presso attività di vendita al dettaglio e di vendita diretta e del personale responsabile della fornitura di mangimi medicati e prodotti intermedi.
1) I farmacisti operanti presso attività di vendita al dettaglio e di vendita diretta di cui all'articolo 23 del presente decreto e i responsabili della fornitura di mangimi medicati e prodotti intermedi, al fine di consentire la registrazione dei medicinali e dei mangimi medicati somministrati agli animali da produzione di alimenti, devono registrare nel sistema di tracciabilità, contestualmente alla dispensazione, le forniture effettuate dietro presentazione di prescrizione medico-veterinaria.
Allegato V
(articolo 38, comma 1)
Pubblicità dei medicinali veterinari presso il pubblico.
1. Definizioni e ambito di applicazione.
1.1 Per «pubblicità dei medicinali veterinari» si intende quanto indicato all'articolo 4, punto 40), del
1.2 Per «pubblicità ricordo» si intende quanto indicato al punto 2.4.
1.3 Per «messaggio pubblicitario» si intende l'insieme delle informazioni sul medicinale veterinario che vengono proposte al pubblico.
1.4 Sono oggetto di pubblicità presso il pubblico i medicinali veterinari non soggetti a prescrizione medico veterinaria autorizzati ai sensi dell'articolo 34, paragrafo 3, del
1.5 Sono, altresì, oggetto di pubblicità presso il pubblico esclusivamente i medicinali omeopatici, come definiti all'articolo 4, punto 10), del
2. Caratteristiche e contenuto minimo dei messaggi pubblicitari.
2.1 La pubblicità dei medicinali veterinari presso il pubblico deve avere caratteristiche conformi a quanto indicato all'articolo 119 del
2.2 Tale pubblicità è realizzata in modo che la natura pubblicitaria del messaggio sia evidente e il prodotto sia chiaramente identificato come medicinale.
2.3 La pubblicità deve comprendere almeno:
a) la denominazione del medicinale veterinario e la denominazione comune del principio attivo; l'indicazione di quest'ultima non è obbligatoria se il medicinale è costituito da più principi attivi;
b) le specie di destinazione, le indicazioni d'uso e le controindicazioni, compreso il divieto di uso in altre specie animali;
c) un invito esplicito e ben evidente a leggere attentamente le avvertenze figuranti, a seconda dei casi, nel foglietto illustrativo o sull'imballaggio esterno;
d) un invito esplicito e ben evidente a consultare il medico veterinario e/o il farmacista;
e) nella pubblicità scritta l'invito deve risultare facilmente leggibile dal normale punto d'osservazione;
f) nella pubblicità sulla stampa quotidiana e periodica l'invito deve essere, comunque, scritto con caratteri di dimensioni non inferiori al corpo nove;
g) il numero e la data dell'autorizzazione rilasciata dal Ministero della salute, tranne che nel caso di pubblicità radiofonica;
h) la pubblicità deve essere altresì conforme a quanto indicato nelle specifiche linee guida comunicate dal Ministero della salute.
2.4 In deroga ai punti sopra riportati, la pubblicità può limitarsi a contenere la sola denominazione del medicinale, qualora essa abbia lo scopo esclusivo di rammentarla (cosiddetta «pubblicità ricordo»).
3. Contenuti pubblicitari non consentiti e limiti alla pubblicità.
3.1 La pubblicità non può comunque contenere alcun elemento che:
a) faccia apparire superflui la consultazione di un medico veterinario o l'intervento chirurgico, in particolare offrendo una diagnosi o proponendo una cura per corrispondenza;
b) induca a ritenere che il medicinale veterinario sia innocuo e dotato di ampio margine di maneggevolezza;
c) induca a ritenere, anche facendo riferimento a dati di farmacovigilanza, che il medicinale veterinario sia privo di effetti collaterali o che la sua efficacia sia superiore o pari a quella di un altro trattamento o di un altro medicinale veterinario;
d) induca a ritenere che il medicinale veterinario sia privo di rischi per la persona che lo somministra e, nel caso di medicinali per uso esterno, per le persone che vivono a contatto con l'animale trattato;
e) induca a ritenere che il medicinale veterinario sia privo di rischi per l'ambiente;
f) induca a ritenere che la mancanza del medicinale veterinario possa avere effetti pregiudizievoli sul normale stato di buona salute dell'animale;
g) comprenda una raccomandazione di scienziati, di associazioni scientifiche o culturali, di operatori sanitari o di persone largamente note al pubblico;
h) assimili il medicinale veterinario a un mangime o ad altro prodotto di consumo;
i) induca a ritenere che la sicurezza o l'efficacia del medicinale veterinario sia dovuta al fatto che si tratti di una sostanza "naturale";
l) possa indurre a una errata diagnosi da parte del proprietario dell'animale;
m) faccia riferimento in modo abusivo, impressionante o ingannevole a certificati di guarigione;
n) utilizzi in modo impressionante e ingannevole rappresentazioni visive di alterazioni del corpo dell'animale dovute a malattie o lesioni;
o) enfatizzi che il medicinale veterinario abbia ricevuto un'autorizzazione all'immissione in commercio;
p) a seguito della ridondanza di altre informazioni, in messaggi o testi, sia occultato l'intento pubblicitario.
4. Autorizzazione dei messaggi pubblicitari.
4.1 La pubblicità dei medicinali veterinari di cui ai punti 1.4 e 1.5 del presente allegato, è consentita solo previa autorizzazione rilasciata dal Ministero della salute, ad eccezione di quella a mezzo stampa prevista dal punto 2.4 del presente allegato, a seguito del parere favorevole espresso dalla Commissione di esperti prevista dall'articolo 201 del testo unico delle leggi sanitarie di cui al
4.2 Il parere della Commissione non è obbligatorio nei seguenti casi:
a) se il messaggio pubblicitario non può essere autorizzato, risultando in evidente contrasto con le disposizioni dell'articolo 119 del
b) se il messaggio rappresenta parte di altro messaggio già autorizzato su parere della Commissione e costituisce un messaggio completo;
c) se il messaggio allegato all'istanza di estensione dell'autorizzazione alla pubblicità risulta identico a quello già autorizzato;
d) nel caso di istanza di estensione ad altra via di diffusione, purchè ricompresa nella fattispecie del messaggio pubblicitario già autorizzato;
e) se il messaggio pubblicitario proposto non tiene conto delle modifiche precedentemente indicate dagli esperti della Commissione;
f) se la Commissione non si riunisce nei tempi utili a rispettare le tempistiche previste dal presente allegato oppure risulta decaduta e non è stata ancora rinominata.
4.3 L'autorizzazione alla pubblicità viene rilasciata al titolare dell'autorizzazione all'immissione in commercio, di seguito denominata «A.I.C.» del medicinale veterinario secondo la seguente procedura:
a) la domanda di autorizzazione del messaggio pubblicitario è presentata dal titolare dell'A.I.C. e deve essere inviata al competente ufficio della Direzione Generale preposta, come indicato nel sito internet del Ministero della salute;
b) la stessa deve essere corredata dalla marca da bollo del valore corrente, da una copia del messaggio pubblicitario completo in ogni sua parte nonchè dall'attestazione dell'avvenuto pagamento della tariffa secondo il valore corrente, stabilita dall'apposito decreto ministeriale;
c) il Ministero della salute rilascia l'autorizzazione entro quarantacinque giorni dalla presentazione della domanda di cui sopra e l'autorizzazione ha validità di ventiquattro mesi, che può essere rinnovata previa presentazione della relativa domanda entro novanta giorni dalla data della scadenza dell'autorizzazione;
d) la tempistica sopra indicata di quarantacinque giorni, che si intende applicata anche alla domanda di rinnovo dell'autorizzazione già rilasciata, non comprende il periodo di tempo che intercorre tra la richiesta e l'invio di integrazioni che si rendessero necessarie.
4.4 Nel caso di richiesta di estensione ad altra via di diffusione, purchè ricompresa nella fattispecie del messaggio pubblicitario già autorizzato, l'estensione si intende rilasciata qualora il Ministero della salute non opponga, entro otto giorni dall'istanza, alcun motivato diniego.
4.5 In caso di diniego all'autorizzazione o alla sua estensione il competente ufficio del Ministero della salute invia una lettera di comunicazione debitamente motivata al titolare dell'A.I.C.