Decisione n. 2006/437/CE della Commissione che approva un manuale diagnostico per l'influenza aviaria secondo quanto previsto dalla direttiva [...]
| Settore: | Normativa europea |
| Materia: | 1. agricoltura |
| Capitolo: | 1.5 polizia sanitaria e igiene |
| Data: | 04/08/2006 |
| Numero: | 437 |
| Sommario |
| Art. 1. Si approva il manuale diagnostico previsto dalla direttiva n. 2005/94/CE e contenuto nell'allegato della presente decisione. |
| Art. 2. Gli Stati membri applicano il manuale diagnostico dalla data di recepimento della direttiva n. 2005/94/CE o dal 1 |
| Art. 3. Gli Stati membri sono destinatari della presente decisione. |
§ 1.5.Q11 - Decisione 4 agosto 2006, n. 437.
Decisione n. 2006/437/CE della Commissione che approva un manuale diagnostico per l'influenza aviaria secondo quanto previsto dalla direttiva 2005/94/CE del Consiglio (Testo rilevante ai fini del SEE)
(G.U.U.E. 31 agosto 2006, n. L 237).
LA COMMISSIONE DELLE COMUNITÀ EUROPEE,
vista la
considerando quanto segue:
(1) La
(2) È necessario determinare a livello comunitario procedure diagnostiche, metodi di campionamento e criteri di valutazione dei risultati degli esami di laboratorio che consentano la conferma di un focolaio di influenza aviaria.
(3) L'allegato VII della
(4) Sono stati recentemente messi a punto esami di laboratorio che consentono una diagnosi rapida dell'influenza aviaria.
(5) L'esperienza acquisita nel corso degli ultimi anni nella lotta contro l'influenza aviaria ha portato all'individuazione delle procedure di campionamento e dei criteri di valutazione dei risultati degli esami di laboratorio più adatti ai fini di una corretta diagnosi della malattia nelle diverse situazioni.
(6) Le misure di cui alla presente decisione sono conformi al parere del comitato permanente per la catena alimentare e la salute degli animali,
HA ADOTTATO LA PRESENTE DECISIONE:
Si approva il manuale diagnostico previsto dalla
Gli Stati membri applicano il manuale diagnostico dalla data di recepimento della
Gli Stati membri sono destinatari della presente decisione.
ALLEGATO
MANUALE DIAGNOSTICO PER L'INFLUENZA AVIARIA
CAPITOLO I
Introduzione, obiettivi e definizioni
1. Al fine di garantire l'uniformità delle procedure di diagnosi dell'influenza aviaria (IA) nella Comunità, il presente manuale stabilisce:
a) orientamenti e requisiti minimi in materia di procedure diagnostiche, metodi di campionamento e criteri di valutazione dei risultati degli esami di laboratorio ai fini di una corretta diagnosi dell'IA;
b) gli esami di laboratorio da utilizzare ai fini della diagnosi dell'IA e le tecniche di laboratorio da impiegare per la tipizzazione genetica degli isolati del virus dell'IA;
c) i requisiti minimi in materia di biosicurezza e le norme di qualità che devono essere rispettati dai laboratori diagnostici e per il trasporto dei campioni.
2. Il presente manuale diagnostico è destinato alle autorità responsabili della lotta contro l'IA. Per questo motivo esso tratta in particolare i principi e le applicazioni degli esami di laboratorio, la valutazione dei relativi risultati e le tecniche di laboratorio.
3. Ai fini del presente manuale diagnostico, oltre alle definizioni di cui all'articolo 2 della
«campione diagnostico»: qualsiasi materiale animale, compresa una carcassa intera, trasportato a fini di diagnosi o di ricerca, ad esclusione però degli animali infetti vivi.
4. La conferma dell'IA nel pollame e in altri volatili in cattività deve avvenire conformemente alle procedure, ai metodi di campionamento e ai criteri di valutazione dei risultati degli esami di laboratorio di cui al presente manuale diagnostico e deve basarsi su uno o più dei criteri enunciati alle seguenti lettere a), b) e c):
a) riconoscimento del virus infettante, dell'antigene o di materiale genetico specifico nei campioni di tessuti, organi, sangue o escreti di pollame o altri volatili;
b) riconoscimento dei segni clinici della malattia e delle relative lesioni post mortem nei volatili;
c) dimostrazione di una risposta anticorpale specifica nei campioni ematici di tali volatili.
5. Nei mammiferi la conferma dell'infezione da virus influenzale A di origine aviaria ad alta patogenicità o, se a bassa patogenicità, dei sottotipi H5 o H7 deve basarsi su uno o più dei criteri enunciati alle lettere a) e b):
a) riconoscimento del virus infettante dell'IA, dell'antigene o di materiale genetico specifico in campioni di tessuti, organi, sangue o escreti dei mammiferi;
b) dimostrazione di una risposta anticorpale specifica all'IA nei campioni ematici dei mammiferi.
6. Le procedure, i metodi di campionamento e i criteri di valutazione dei risultati degli esami di laboratorio devono essere:
a) quelli descritti nel presente manuale; oppure
b) quelli autorizzati dall'autorità competente, purché:
i) in base a una prova comparativa organizzata dal laboratorio comunitario di riferimento per l'influenza aviaria («laboratorio comunitario di riferimento») sia comprovata la sensibilità e la specificità degli esami del laboratorio autorizzato; oppure
ii) nel caso in cui il laboratorio comunitario di riferimento non abbia organizzato questa valutazione per uno specifico tipo di test di laboratorio, la sensibilità e la specificità del test del laboratorio autorizzato siano state convalidate dal laboratorio nazionale di riferimento e pertanto detto test di laboratorio risulti idoneo allo scopo per il quale è utilizzato. I risultati della convalida devono essere sottoposti all'esame del laboratorio comunitario di riferimento.
CAPITOLO II
Descrizione dell'IA con particolare riferimento alla diagnosi differenziale
1. Eziologia e virulenza
L'IA è un'infezione virale estremamente contagiosa causata dai virus della famiglia Orthomyxoviridae, genere Influenzavirus A. I virus dell'influenza A sono gli unici ortomixovirus di cui sia accertata la capacità di infettare i volatili. È stato dimostrato che molte specie di volatili sono suscettibili all'infezione da parte dei virus dell'influenza A; i volatili acquatici costituiscono un importante serbatoio di questi virus, ma la stragrande maggioranza degli isolati virali sono risultati a bassa patogenicità nei polli e nei tacchini, che sono i principali volatili di interesse economico ad essere colpiti dalla malattia.
I virus dell'influenza A contengono nucleoproteine antigenicamente correlate e proteine di matrice antigenicamente correlate, ma vengono classificati in sottotipi in base alla correlazione antigenica delle glicoproteine di superficie emoagglutinina (HA) e neuraminidasi (NA). Finora si conoscono 16 sottotipi HA (H1–H16) e 9 sottotipi NA (N1– N9). Ogni virus influenzale A possiede un antigene HA e un antigene NA, apparentemente in qualsiasi combinazione.
I virus influenzali A sono suddivisi in due gruppi, a seconda della loro capacità di provocare la malattie nel pollame suscettibile all'infezione:
a) virus dell'influenza aviaria ad alta patogenicità (HPAI), che causano una malattia estremamente grave, caratterizzata da un'infezione generalizzata del pollame colpito, nel quale possono indurre una mortalità in allevamento molto elevata (fino al 100 %);
b) virus dell'influenza aviaria a bassa patogenicità (LPAI), che causano nel pollame un'affezione leggera, prevalentemente respiratoria, salvo aggravamento dovuto ad altre coinfezioni o ad altri fattori.
I volatili selvatici, soprattutto gli uccelli acquatici migratori, svolgono un ruolo molto importante quale serbatoio del virus influenzale A, come dimostrato dall'isolamento di quasi tutte le combinazioni possibili dei sottotipi HA e NA in tali animali. In genere nei volatili selvatici vengono rilevati soltanto i virus LPAI, salvo nel caso di trasmissione (spill—over) dell'HPAI da pollame infetto.
Con ogni probabilità l'introduzione primaria dei virus dell'IA nelle aziende avicole deriva dal contatto diretto o indiretto con volatili selvatici.
Nel pollame domestico è possibile che tali virus LPAI introdotti da un serbatoio selvatico circolino senza essere rilevati, in quanto i segni clinici sono spesso leggeri o assenti.
Una volta introdotti tra il pollame, i ceppi virali LPAI dei sottotipi H5 e H7 possono successivamente mutare in ceppi HPAI. Finora è stato dimostrato che solo i virus dei sottotipi H5 e H7 provocano l'HPAI.
Sembra che vari meccanismi possano determinare la mutazione del virus LPAI in virus HPAI, anche se non sono noti i fattori alla base di tale mutazione. In alcuni casi sembra che la mutazione sia avvenuta rapidamente nel luogo del focolaio primario dopo l'introduzione del virus da parte di volatili selvatici; in altri casi il virus LPAI ha circolato per mesi tra il pollame prima di subire la mutazione. È quindi impossibile prevedere se e quando si verificherà tale mutazione.
Tuttavia si può ragionevolmente ritenere che le probabilità di una mutazione in virus HPAI siano tanto più elevate quanto più diffusa è la circolazione del virus LPAI tra il pollame.
È difficile stimare il periodo di incubazione, che tra l'altro varia probabilmente a seconda del ceppo virale e dell'ospite; il dato indicato di solito è di cinque-sei giorni, ma verosimilmente la durata del periodo di incubazione nei singoli volatili è compresa tra qualche ora e sette giorni circa.
2. Segni clinici nei volatili infettati dal virus HPAI
I segni clinici sono molto variabili e risultano influenzati da diversi fattori, quali la virulenza dell'agente infettante, la specie colpita, l'età, il sesso, altre patologie concomitanti e l'ambiente.
I primi segni comprendono l'inappetenza, una riduzione dell'assunzione d'acqua e una mortalità relativamente modesta. Tuttavia la malattia può anche manifestarsi all'improvviso in un allevamento e provocare la morte di molti volatili senza la comparsa di segni premonitori oppure con la comparsa di segni minimi di depressione, inappetenza, piume arruffate e febbre. In genere i segni clinici sono tanto più evidenti quanto più lungo è il periodo di sopravvivenza dei volatili. I tempi della comparsa dei segni dipendono dal virus, dall'ospite e dalla dose infettante iniziale oltre che dal sistema di allevamento. Il virus si diffonde più lentamente tra le ovaiole in batteria o tra i volatili che vivono all'aperto rispetto a quanto non avvenga nei capannoni per i polli da carne.
Inizialmente può accadere che le galline infettate dal virus HPAI depongano uova dal guscio morbido, ma ben presto smettono di deporre uova. I volatili malati spesso restano accovacciati o in posizione eretta in uno stato semicomatoso, con la testa che tocca il suolo. Cresta e bargiglio hanno un aspetto cianotico ed edematoso e possono essere contraddistinti sulla punta da petecchie ed ecchimosi di natura emorragica. Frequente è una diarrea acquosa profusa, con una sete eccessiva degli esemplari malati. La respirazione può essere difficoltosa e si può riscontrare una lacrimazione abnorme. Nelle parti esposte, non coperte da piumaggio, si possono evidenziare emorragie. Il tasso di mortalità nell'allevamento va dal 50 al 100 %.
Nei polli da carne i segni dell'HPAI sono spesso meno evidenti che negli altri tipi di pollame; tra le prime anomalie osservate si annoverano depressione grave, inappetenza e un forte aumento della mortalità. Possono essere presenti anche edema facciale e al collo e segni neurologici come torcicollo e atassia.
Nei tacchini l'HPAI è simile a quella osservata nei polli domestici, ma nei primi alcuni virus HPAI sembrano più virulenti, mentre altri sembrano esserlo meno.
Nelle oche infettate dal virus HPAI i segni come la depressione, l'inappetenza e la diarrea sono simili a quelli osservati nelle galline ovaiole, ma sono spesso accompagnati da tumefazione dei seni. Gli esemplari più giovani possono mostrare segni neurologici.
È possibile che le anatre infettate da virus HPAI non presentino alcun segno clinico, ma è stato segnalato che alcuni ceppi produrrebbero segni simili a quelli riscontrati nelle oche e una certa mortalità.
Negli struzzi le infezioni da virus HPAI e LPAI possono non essere associate a segni clinici. In focolai di HPAI, come quelli registrati in Italia nel 1999/2000, è risultato che le faraone e le quaglie giapponesi erano suscettibili alle infezioni con segni clinici e mortalità analoghi a quelli riscontrati nei polli o nei tacchini. Tuttavia alcuni studi sperimentali hanno evidenziato la resistenza delle quaglie ad alcuni ceppi HPAI. In tutti i volatili la presenza di anticorpi nei confronti dello stesso sottotipo H, indotta dalla vaccinazione o da un'infezione naturale, può significare che l'infezione da virus HPAI non determina segni clinici evidenti.
3. Lesioni post mortem nei volatili infettati dal virus HPAI
I volatili che muoiono di malattia iperacuta possono mostrare lesioni macroscopiche minime, dovute a disidratazione e congestione dei visceri e dei muscoli.
Nei volatili che invece muoiono dopo un decorso clinico più lungo si osservano petecchie ed ecchimosi di natura emorragica in tutto il corpo, specialmente a livello di laringe, trachea, proventricolo e grasso epicardico e sulle superfici sierose adiacenti allo sterno. Si riscontra un esteso edema sottocutaneo, soprattutto intorno alla testa e alle zampe. La carcassa può presentare segni di disidratazione. Focolai necrotici grigio-giallastri possono essere presenti in corrispondenza di milza, fegato, reni e polmoni. Il sacco aereo può contenere essudato. La milza può essere ipertrofica ed emorragica.
Dal punto di vista istologico l'IA è caratterizzata da alterazioni vascolari che determinano edema, emorragie e manicotti perivascolari, soprattutto a carico di miocardio, milza, polmoni, cervello, pancreas e bargigli. Focolai necrotici sono presenti a livello di polmoni, fegato e reni. A livello cerebrale si possono riscontrare gliosi, proliferazione vascolare e degenerazione neuronale.
4. Diagnosi differenziale
Nella diagnosi differenziale dell'HPAI si devono considerare, in particolare, le seguenti malattie:
a) altre malattie responsabili di elevata mortalità improvvisa, quali:
i) malattia di Newcastle;
ii) laringotracheite infettiva;
iii) peste delle anatre;
iv) avvelenamenti acuti;
b) altre malattie che producono gonfiore di cresta e bargiglio, quali:
i) colera aviario acuto e altre malattie setticemiche;
ii) cellulite batterica di cresta e bargiglio.
5. Segni clinici nei volatili infettati da virus LPAI
La gravità della malattia provocata dai virus LPAI è fortemente influenzata dai seguenti fattori:
a) il ceppo virale;
b) la specie e l'età dell'ospite;
c) lo stato immunitario dell'ospite nei confronti del virus e in particolare la presenza di altri agenti infettivi quali:
i) Pasteurella spp.;
ii) virus della malattia di Newcastle (compresi i ceppi vaccinali);
iii) pneumovirus aviario, virus della bronchite infettiva;
iv) E. coli;
v) Mycoplasma spp.;
d) stati di immunodeficienza;
e) fattori ambientali (quali eccesso di ammoniaca, polvere, alte o basse temperature).
Da un lato i segni clinici della malattia possono essere inapparenti o leggeri, caratterizzati soltanto da una modesta sintomatologia respiratoria o da problemi nella deposizione delle uova per quanto riguarda gli esemplari ovaioli.
Dall'altro si possono avere infezioni da virus LPAI accompagnate, soprattutto nei tacchini, da segni clinici gravi della patologia, di solito accompagnata da rantoli, tosse, tumefazione dei seni infraorbitali e ipertermia associata a perdita di appetito e ad elevata mortalità.
Molte altre patologie che presentano segni respiratori o enterici possono essere confuse con l'LPAI o costituire sue complicanze. Si deve sospettare l'insorgenza dell'influenza aviaria in presenza di qualsiasi altra epidemia del pollame che persista nonostante l'adozione delle misure preventive e terapeutiche previste per altre malattie.
6. Segni clinici nei volatili in cattività
Si può registrare un'ampia gamma di segni clinici che possono variare da segni inapparenti a segni gravi con conseguente mortalità elevata.
In genere l'infezione si diffonde più lentamente tra un insieme eterogeneo di volatili in cattività, data la varietà di specie detenute che presentano una diversa sensibilità, livelli disomogenei di eliminazione del virus (shedding) e una trasmissione spesso relativamente modesta dovuta a un basso tasso di contatto e a densità di popolamento relativamente basse.
CAPITOLO III
Orientamenti ai quali rifarsi in presenza di un sospetto di influenza aviaria in un'azienda
La variabilità dei segni clinici dell'HPAI e dell'LPAI determina l'impossibilità di disporre di orientamenti univoci in presenza di un sospetto focolaio. Una mortalità improvvisa ed elevata del pollame, accompagnata o meno dai segni clinici associati descritti nel capitolo II, deve essere studiata mediante la presentazione di campioni da sottoporre ad analisi di laboratorio; in assenza di una mortalità elevata risulta invece difficile sospettare o escludere la presenza dell'IA.
Dato che una diagnosi rapida dell'HPAI o dell'LPAI provocata dai sottotipi H5 e H7 è estremamente importante nelle prime fasi di lotta e di eradicazione, in presenza di problemi respiratori, problemi nella deposizione delle uova e a fronte di un'elevata mortalità del pollame è necessario prendere sempre in considerazione l'IA nella diagnosi differenziale; occorre inoltre sottoporre ad accertamenti di laboratorio campioni appropriati.
Figura
Schema delle fasi diagnostiche atte a confermare l'IA
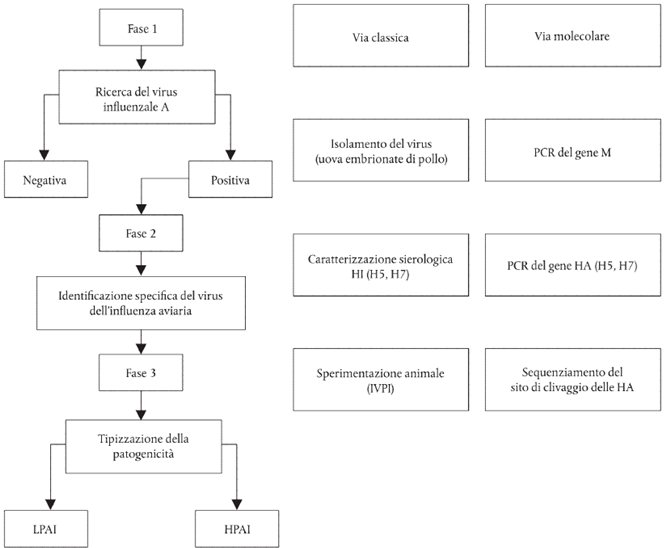
CAPITOLO IV
Procedure generali per la raccolta e il trasporto dei campioni
1.
Nei casi in cui la
2. Procedure da seguire qualora si sospettino focolai di IA
Qualora il veterinario ufficiale abbia il sospetto clinico di un focolaio di influenza aviaria o qualora non siano negativi i risultati di uno qualsiasi degli esami di laboratorio previsto per detta malattia, l'autorità competente deve garantire l'esecuzione, a norma dell'articolo 7 della
3. Interpretazione dei test virologici
L'autorità competente può ritenere esclusa la presenza del virus dell'IA nel caso in cui sia stato presentato, nel rispetto di quanto previsto dal presente capitolo, un congruo numero di volatili morti o ammalati e di tamponi tracheali/orofaringei o cloacali per il riconoscimento del virus o del genoma virale e siano risultati negativi i test eseguiti su di essi utilizzando una delle metodiche di ricerca del virus indicate nel capitolo V o VI o una metodica autorizzata dall'autorità competente conformemente al punto 6, lettera b), del capitolo I.
4. Set di campioni standard per i test virologici o sierologici di laboratorio
Per effettuare l'indagine in un'azienda in cui si sospetta la presenza dell'infezione da virus dell'IA, occorre prelevare e sottoporre direttamente ai test virologici e sierologici di laboratorio i set di campioni standard per dette analisi elencati alle lettere a) e b) («campioni standard»).
a) Il set di campioni standard per i test virologici è costituito da:
i) almeno cinque volatili malati/morti, laddove ce ne siano; e/o
ii) perlomeno 20 tamponi tracheali/orofaringei e 20 tamponi cloacali.
Devono essere raccolte le carcasse dei volatili morti di recente o gravemente malati o moribondi e abbattuti in modo eutanasico.
I tamponi devono essere prelevati dal numero di volatili di cui alla lettera a) o da tutti i volatili di un'azienda in cui si sospetta l'infezione, laddove il numero di volatili in essa presente sia inferiore a detto numero. Ai fini del campionamento devono essere scelti in modo mirato i volatili che presentano segni clinici della malattia.
I tamponi cloacali devono essere ricoperti di feci (optimum 1 g). Se per qualche motivo non è possibile prelevare tamponi cloacali da volatili vivi, un'alternativa può essere data da campioni di feci fresche raccolte con cura.
Spesso la soluzione più funzionale consiste nel raccogliere tamponi tracheali/orofaringei dalla cavità orale.
Non appena si conoscono le caratteristiche della crescita virale, l'autorità competente può decidere di optare per i tamponi tracheali/orofaringei o per quelli cloacali, invece di raccoglierli entrambi, a seconda che la replicazione del virus avvenga meglio nell'apparato respiratorio o in quello gastrointestinale, tenuto conto anche delle specie interessate.
b) Il set di campioni standard per i test sierologici è costituito da un minimo di 20 campioni ematici.
I campioni devono essere prelevati dal numero di volatili di cui alla lettera b) o da tutti i volatili di un'azienda, laddove il numero di volatili in essa presente sia inferiore a detto numero. Ai fini del campionamento devono essere scelti in modo mirato i volatili che sembrano malati o quelli apparentemente guariti.
L'autorità competente può decidere che non sia necessario il prelievo dell'intero set di campioni standard e che si possa invece ricorrere a un set parziale di campioni standard.
5. Trasporto dei campioni
È necessaria una cura particolare per quanto concerne la conservazione e il trasporto dei campioni al laboratorio dove verranno analizzati.
I tamponi devono essere subito refrigerati con ghiaccio o con panetti di gel ghiacciato e fatti pervenire al laboratorio con la massima tempestività. I campioni non devono essere congelati a meno che ciò non sia assolutamente necessario. Se non è sicuro che il trasporto al laboratorio possa avvenire rapidamente entro 24 ore, i campioni devono essere immediatamente congelati, immagazzinati e successivamente trasportati in ghiaccio secco.
Oltre a ciò e non in alternativa alla refrigerazione, i tamponi devono essere posti in un terreno di trasporto antibiotico o specifico per virus a 4 °C in modo da risultare completamente immersi. In assenza di tale terreno di trasporto, i tamponi devono essere nuovamente inseriti nei loro contenitori e fatti pervenire allo stato secco al laboratorio dove verranno eseguiti i test.
La conservazione e il trasporto dei campioni possono essere condizionati da una serie di fattori; di conseguenza il metodo prescelto per il trasporto deve essere adatto allo scopo.
6. Terreno antibiotico
Il terreno antibiotico di cui al punto 5 deve essere a base di una soluzione salina tampone fosfato con pH compreso tra 7,0 e 7,4 (da verificare dopo l'aggiunta dell'antibiotico).
I terreni a base di proteine, come il terreno BHI (infuso di cuore e cervello) o il triptosio tampone tris, possono conferire maggiore stabilità al virus, soprattutto durante il trasporto. Gli antibiotici utilizzati e le relative concentrazioni possono essere modificati a seconda della disponibilità e delle condizioni in loco.
Livelli di antibiotico molto elevati possono essere necessari per i campioni fecali e i quantitativi idonei sono: 10 000 UI/ml di penicillina, 10 mg/ml di streptomicina, 0,25 mg/ml di gentamicina e 5 000 UI/ml di nistatina.
Questi dosaggi possono essere ridotti al massimo di cinque volte per i tessuti e i tamponi tracheali.
Occorre aggiungere 0,05-0,1 mg/ml di ossitetraciclina, se si intende eseguire una ricerca per la Chlamydophila.
7. Terreno BHI (infuso di cuore e cervello)
La soluzione deve essere preparata in acqua e contenere prima della sterilizzazione (in autoclave a 121 °C per 15 minuti) il 15 % p/v di brodo BHI (infuso di cuore e cervello) liofilizzato.
Dopo la sterilizzazione devono essere aggiunti gli antibiotici come segue: 10 000 UI/ml di penicillina G, 20 μg di amfotericina B e 1 000 μg/ml di gentamicina. I terreni possono essere conservati a 4 °C per un massimo di due mesi.
8. Procedure da eseguire in relazione alle pertinenti disposizioni della
8.A. Sospetti focolai
8.1. Articolo 7, paragrafo 1 — Misure da applicare nelle aziende in cui si sospettano focolai
Quando un veterinario ufficiale effettua un'ispezione in un'azienda in cui si sospetta un focolaio, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda. Nella relazione ispettiva del veterinario ufficiale devono essere documentati i dati relativi alla mortalità giornaliera, i dati giornalieri di produzione delle uova, il consumo di mangime e/o di acqua per il periodo che va da una settimana prima della comparsa dei segni clinici dell'IA fino all'ispezione dell'azienda da parte del veterinario medesimo;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione dell'anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) a meno che l'autorità competente non ritenga possibile escludere il sospetto focolaio in base all'ispezione clinica condotta conformemente alle lettere a) e b), si deve procedere al prelievo dei campioni standard da ogni unità produttiva;
d) indipendentemente dai risultati negativi dei test eseguiti sui campioni standard e tenuto conto dei fattori locali, occorre effettuare l'ispezione clinica del pollame in ciascuna unità produttiva prima che si possa revocare la sorveglianza officiale.
8.2. Articolo 10, paragrafo 3 — Misure aggiuntive fondate su un'indagine epidemiologica
In ciascuna unità produttiva devono essere prelevati campioni standard dal pollame o dagli altri volatili abbattuti.
8.B. Influenza avi ar ia ad alta patogeni c i tà (HPAI)
8.3. Articolo 11, paragrafo 4 — Misure da applicare ai pulcini nati da uova raccolte in aziende in cui i focolai sono confermati
Quando un veterinario ufficiale effettua un'ispezione in un'azienda in cui sono presenti pulcini nati da uova raccolte durante il periodo di incubazione in un'azienda in cui l'HPAI è stata confermata, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda. Nella relazione del veterinario ufficiale sull'ispezione all'azienda devono essere documentati, se disponibili i dati relativi alla mortalità giornaliera e i dati giornalieri del consumo di mangime e/o di acqua per il periodo che va da una settimana prima della comparsa dei segni clinici dell'HPAI fino all'ispezione dell'azienda da parte del veterinario medesimo;
b) ispezione clinica di ogni unità produttiva ed esame clinico del pollame, soprattutto di quello che sembra malato o non cresce normalmente;
c) i campioni standard devono essere prelevati dai pulcini di età compresa tra le due e le tre settimane;
d) la sorveglianza ufficiale dell'azienda può essere revocata dopo l'esame clinico dei pulcini di età superiore a 21 giorni e alla luce dei risultati negativi dei test eseguiti sui campioni standard.
8.4. Articolo 13, paragrafo 2, lettera b) — Deroghe relative a talune aziende
Quando un veterinario ufficiale effettua un'ispezione in un'azienda cui sia stata concessa una deroga rispetto a quanto previsto dall'articolo 11, paragrafo 2, della
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) invece dei campioni standard, ai fini degli esami di laboratorio devono essere prelevati i seguenti campioni, una volta decorsi 21 giorni dall'ultimo riscontro positivo per l'HPAI in ogni unità produttiva e poi successivamente a intervalli di 21 giorni:
i) campioni di eventuali capi di pollame o altri volatili in cattività morti, presenti al momento del campionamento;
ii) laddove ciò risulti fattibile, tamponi tracheali/orofaringei e cloacali prelevati da almeno 60 capi di pollame o altri volatili in cattività, oppure da tutti i capi di pollame o altri volatili in cattività se il loro numero nell'azienda è inferiore a 60. Devono essere prelevati campioni di feci fresche, se i volatili sono piccoli, esotici e non abituati a essere maneggiati oppure se maneggiarli potrebbe risultare pericoloso per le persone.
In base all'esito di una valutazione del rischio, l'autorità competente può tuttavia concedere deroghe per quanto concerne la dimensione dei campioni di cui ai punti i) e ii);
d) il campionamento di cui alla lettera c) e gli esami di laboratorio su tali campioni devono continuare finché non si ottengano, a un intervallo minimo di 21 giorni, due risultati di laboratorio negativi consecutivi.
8.5. Articolo 15, paragrafi 1 e 3 — Misure da applicare nelle aziende a contatto
Quando un veterinario ufficiale effettua un'ispezione in un'azienda a contatto, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda. Nella relazione del veterinario ufficiale sull'ispezione all'azienda devono essere documentati, se disponibili, i dati relativi alla mortalità giornaliera e i dati giornalieri del consumo di mangime e/o di acqua per il periodo che va da una settimana prima del contatto con l'allevamento che si sospetta essere infetto da IA fino alla data dell'ispezione dell'azienda da parte del veterinario medesimo;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) se il pollame o gli altri volatili in cattività presentano segni clinici o esistono segnali di un aumento della mortalità giornaliera (oltre tre volte superiore rispetto al normale tasso di mortalità dell'allevamento) o se si registra un calo nella produzione giornaliera di uova (superiore al 5 %) o una diminuzione del consumo giornaliero di mangime e/o di acqua (superiore al 5 %), si deve immediatamente procedere al prelievo dei campioni standard in ogni unità produttiva;
d) se non si constata nulla di quanto indicato alle lettere b) e c), i campioni standard devono essere prelevati 21 giorni dopo la data dell'ultimo sospetto di contatto con un'azienda infetta oppure al momento dell'abbattimento del pollame o degli altri volatili in cattività.
8.6. Articolo 18, lettere b) e c) — Censimento, visite a cura del veterinario ufficiale e sorveglianza nelle aziende ubicate nella zona di protezione
Quando un veterinario ufficiale effettua un'ispezione in un'azienda commerciale, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda. Se esistono segnali di un aumento della mortalità giornaliera (oltre tre volte superiore rispetto al normale tasso di mortalità dell'allevamento) o se si registra un calo nella produzione giornaliera di uova (superiore al 5 %) o una diminuzione del consumo giornaliero di mangime e/o di acqua (superiore al 5 %), si deve procedere al prelievo dei campioni standard in ogni unità produttiva;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame e degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) quando la manifestazione chiara dei segni clinici della malattia non è attesa nelle specie di pollame o degli altri volatili in cattività interessati oppure quando si è in presenza di volatili vaccinati, l'autorità competente può, in base all'esito di una valutazione di rischio, decidere che i campioni standard debbano essere prelevati in ogni unità produttiva;
d) in base all'esito di una valutazione di rischio, l'autorità competente deve decidere in merito a un'ulteriore sorveglianza ufficiale che deve essere realizzata attraverso ispezioni cliniche e mediante un campionamento per le analisi di laboratorio in aziende, comparti o tipi di produzione mirati.
8.7. Articolo 19, lettera f) — Misure da applicare nelle aziende all'interno delle zone di protezione
Quando un veterinario ufficiale effettua un'ispezione in un'azienda in cui siano stati segnalati aumenti della morbilità, della mortalità o modifiche dei livelli di produzione, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda. Se esistono segnali di un aumento della mortalità giornaliera (oltre tre volte superiore rispetto al normale tasso di mortalità dell'allevamento) o se si registra un calo nella produzione giornaliera di uova (superiore al 5 %) o una diminuzione del consumo giornaliero di mangime e/o di acqua (superiore al 5 %), si deve procedere al prelievo dei campioni standard in ogni unità produttiva;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati.
8.8. Articolo 23, lettera b) — Deroghe per il trasporto diretto di pollame destinato alla macellazione immediata
Quando un veterinario ufficiale effettua un'ispezione in un'azienda cui sia stata concessa una deroga rispetto a quanto previsto dall'articolo 22 della
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame, in particolare di quei capi che sembrano malati, da effettuare a meno di 24 ore dalla partenza;
c) in base all'esito di una valutazione di rischio condotta dall'autorità competente, invece dei campioni standard devono essere prelevati dal pollame di ciascuna unità produttiva destinato alla macellazione almeno 60 tamponi tracheali/orofaringei e/o 60 tamponi cloacali, a meno di 48 ore dalla partenza.
8.9. Articolo 25, lettera b) — Deroghe per il trasporto diretto di pollastre
Quando un veterinario ufficiale effettua un'ispezione in un'azienda cui sia stata concessa una deroga rispetto a quanto previsto dall'articolo 22 della
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici delle pollastre, in particolare di quei capi che sembrano malati, da effettuare a meno di 24 ore dalla partenza;
c) in base all'esito di una valutazione di rischio condotta dall'autorità competente, invece dei campioni standard devono essere prelevati almeno 60 tamponi tracheali/orofaringei e/o 60 tamponi cloacali dalle pollastre di ciascuna unità produttiva destinate al trasporto, a meno di 48 ore dalla partenza.
8.10. Articolo 26, paragrafo 1, lettera a) — Deroga per il trasporto di uova da cova e da tavola
Quando un veterinario ufficiale effettua un'ispezione in un'azienda di riproduttori cui sia stata concessa una deroga rispetto a quanto previsto dall'articolo 22 della
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva ogni 15 giorni;
c) i campioni standard devono essere prelevati in ogni unità produttiva.
8.11. Articolo 29, paragrafo 1 — Durata delle misure
Le misure che si applicano nella zona di protezione in forza del capo IV, sezione 3, della
a) tutte le aziende commerciali ubicate nella zona di protezione siano state ispezionate da un veterinario ufficiale e tutti i controlli, le ispezioni cliniche e gli esami di laboratorio di cui al punto 8.6, lettere a), b) e c), e al punto 8.7 abbiano avuto esito negativo;
b) tutte le aziende non commerciali individuate nella zona di protezione siano state ispezionate da un veterinario ufficiale e né gli esami clinici né i risultati degli esami di laboratorio effettuati abbiano fatto insorgere il sospetto di un'infezione da IA;
c) qualsiasi ulteriore sorveglianza ufficiale condotta secondo quanto indicato al punto 8.6, lettera d), abbia dato esito negativo.
8.12. Articolo 30, lettera g) — Misure da applicare nelle zone di sorveglianza
Quando un veterinario ufficiale effettua un'ispezione in un'azienda in cui siano stati segnalati aumenti della morbilità, della mortalità o modifiche dei livelli di produzione, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) i campioni standard devono essere prelevati in ogni unità produttiva.
8.13. Articolo 35 — Accertamenti per sospetta presenza dell'HPAI nei macelli e nei mezzi di trasporto
Quando, in caso di sospetta presenza dell'HPAI nei macelli e nei mezzi di trasporto, un veterinario ufficiale effettua un'ispezione nell'azienda di origine dei volatili, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, alla luce della consultazione del veterinario ufficiale del macello, che deve fornire i dati relativi a eventuali precedenti ispezioni e informazioni circa i risultati degli esami ante e post mortem;
c) a meno che l'autorità competente, in base all'ispezione veterinaria condotta conformemente alle lettere a) e b), non ritenga possibile escludere la sospetta presenza dell'HPAI, si deve procedere al prelievo dei campioni standard da ogni unità produttiva;
d) oltre ai campioni standard devono essere sottoposti agli esami di laboratorio i campioni di almeno cinque volatili malati, morti o macellati nel macello, che presentino un quadro patologico.
8.14. Articolo 36, paragrafo 1 — Misure da applicare nei macelli
Terminati gli accertamenti di cui al punto 8.13, il controllo ufficiale può essere revocato, purché i risultati degli esami di laboratorio siano negativi e non ci sia alcun sospetto clinico della presenza dell'HPAI nell'azienda d'origine e nel macello.
8.15. Articolo 37, paragrafi 1 e 2 — Misure da applicare nei posti d'ispezione frontalieri o nei mezzi di trasporto
8.15.1. Quando un veterinario ufficiale esamina il pollame o gli altri volatili in cattività posti in isolamento, previo trasferimento da un posto d'ispezione frontaliero o da un mezzo di trasporto, a causa di un sospetto o di una conferma della presenza dell'HPAI, devono essere eseguite le seguenti procedure:
a) verifica dei documenti e dei registri pertinenti eventualmente esistenti;
b) esame clinico del pollame o degli altri volatili in cattività tenuti in isolamento, nonché ispezione clinica degli eventuali altri capi di pollame o degli eventuali altri volatili in cattività, in particolare di quelli che sembrano malati;
c) i campioni standard devono essere prelevati dal pollame o dagli altri volatili in cattività che vanno scelti nelle diverse gabbie o contenitori per il trasporto.
8.15.2. Quando, nel caso di pollame o altri volatili in cattività macellati, il veterinario ufficiale effettua l'ispezione in una determinata azienda di origine, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, alla luce della consultazione del veterinario ufficiale del macello, che deve fornire i dati relativi a eventuali precedenti ispezioni e informazioni circa i risultati degli esami ante e post mortem;
c) a meno che l'autorità competente, in base all'ispezione veterinaria condotta conformemente alle lettere a) e b), non ritenga possibile escludere la sospetta presenza dell'HPAI, si deve procedere al prelievo dei campioni standard da ogni unità produttiva;
d) oltre ai campioni standard di cui alla lettera c) devono essere sottoposti agli esami di laboratorio i campioni di almeno cinque volatili malati, morti o macellati nel macello, che presentino un quadro patologico;
e) il controllo ufficiale può essere revocato purché i risultati degli esami di laboratorio di cui alle lettere c) e d) siano negativi e non ci sia alcun sospetto clinico di HPAI nell'azienda d'origine e nel macello.
8.C. Influenza avi ar ia a bassa patogenic i tà (LPAI)
8.16. Articolo 39, paragrafo 6, lettere b) e h) — Misure da applicare nelle aziende in cui i focolai sono confermati
Quando un veterinario ufficiale effettua un'ispezione in un'azienda prima del trasporto del pollame a un macello oppure esegue un'ispezione in un'azienda in cui sono presenti pulcini nati da uova raccolte durante il periodo di incubazione, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività;
c) i campioni standard devono essere prelevati, meno di 48 ore prima della partenza, dai volatili destinati alla macellazione di ciascuna unità produttiva;
d) i campioni standard devono essere prelevati in ciascuna unità produttiva dai pulcini nati da uova raccolte durante il periodo di incubazione.
8.17. Articolo 40, paragrafo 2, lettera b) — Deroghe per talune aziende rispetto alle misure da applicare in caso di conferma dei focolai
Quando un veterinario ufficiale effettua un'ispezione in un'azienda cui sia stata concessa una deroga rispetto a quanto previsto dall'articolo 39, paragrafo 2, e dall'articolo 39, paragrafo 5, lettera b), della
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica periodica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) ai fini degli esami di laboratorio invece dei campioni standard devono essere prelevati i seguenti campioni, una volta decorsi 21 giorni dall'ultimo riscontro positivo per l'LPAI in ogni unità produttiva e poi successivamente a intervalli di 21 giorni:
i) campioni di eventuali capi di pollame o altri volatili in cattività morti, presenti al momento del campionamento;
ii) tamponi tracheali/orofaringei e cloacali prelevati da 60 capi di pollame e altri volatili in cattività oppure da tutti i capi di pollame o altri volatili in cattività, se il loro numero nell'azienda è inferiore a 60. Devono essere prelevati campioni di feci fresche, se i volatili o gli altri volatili in cattività sono piccoli, esotici e non abituati a essere maneggiati oppure se maneggiarli potrebbe risultare pericoloso per le persone.
In base all'esito di una valutazione del rischio, l'autorità competente può tuttavia concedere deroghe per quanto concerne la dimensione dei campioni di cui ai punti i) e ii);
d) il campionamento di cui alla lettera c) e gli esami di laboratorio su tali campioni devono continuare finché non si ottengano, a un intervallo minimo di 21 giorni, due risultati di laboratorio negativi consecutivi.
8.18. Articolo 42, paragrafi 1 e 3 — Misure da applicare nelle aziende a contatto
Quando un veterinario ufficiale effettua un'ispezione in un'azienda a contatto, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda a contatto;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) i campioni standard devono essere prelevati in ciascuna unità produttiva oppure in occasione dell'abbattimento del pollame o degli altri volatili in cattività.
8.19. Articolo 44, paragrafo 1, lettera b) — Misure da applicare nelle zone di restrizione
Quando un veterinario ufficiale effettua un'ispezione in un'azienda commerciale ubicata in una zona di restrizione, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) i campioni standard devono essere prelevati in ogni unità produttiva;
d) in base all'esito di una valutazione di rischio, l'autorità competente deve decidere in merito a un'ulteriore sorveglianza ufficiale che deve realizzata attraverso ispezioni cliniche e mediante un campionamento per le analisi di laboratorio in aziende, comparti o tipi di produzione mirati.
8.20. Articolo 45, lettere a) e b) — Durata delle misure
Le misure che si applicano nella zona di restrizione in forza del capo V, sezione 3, della
a) tutte le aziende commerciali ubicate nella zona di restrizione siano state ispezionate da un veterinario ufficiale, siano stati eseguiti tutti gli esami di laboratorio relativi ai campioni di cui al punto 8.13, lettere c) e d), e siano disponibili i relativi risultati di questi esami;
b) siano disponibili i risultati di eventuali ulteriori ispezioni cliniche ed esami di laboratorio, che possono interessare anche le aziende non commerciali per determinare il rischio di diffusione dell'LPAI;
c) l'autorità competente ritenga trascurabile il rischio di diffusione dell'LPAI in base all'esito di una valutazione di rischio che tenga conto della situazione epidemiologica e dei risultati degli esami di laboratorio di cui alle lettere a) e b). La valutazione può contenere conclusioni a favore di un'eventuale revoca delle restrizioni in presenza di risultati sierologici positivi e di risultati virologici negativi.
8.D. Mi sur e finalizzate a impedi r e la di ffusione di vi rus influenzali avia ri ad a ltre spec i e
8.21. Articolo 47, paragrafi 1 e 6 — Esami di laboratorio e altre misure riguardanti i suini e altre specie
Quando, a seguito della conferma dell'IA, un veterinario ufficiale effettua un'ispezione in un'azienda di allevamento suinicolo, devono essere eseguite le seguenti procedure:
a) verifica degli eventuali registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici dei suini, in particolari di quei capi che sembrano malati;
c) il giorno prima o il giorno stesso dell'abbattimento del pollame o degli altri volatili in cattività infetti, devono essere prelevati tamponi nasali/orofaringei da almeno 60 suini in ogni unità produttiva o da tutti i suini presenti nell'unità produttiva, laddove il numero di suini in esse presenti sia inferiore a 60. Entro due-quattro settimane dalla data dell'abbattimento devono essere prelevati almeno 60 campioni ematici dai suini. I campioni devono essere raccolti in modo tale da ottenere almeno un campione da ciascun gruppo di suini che siano in diretto contatto tra loro;
d) il trasporto dei suini verso altre aziende può essere autorizzato qualora siano risultati negativi almeno 60 tamponi nasali/orofaringei e 60 campioni ematici prelevati dai suini in ciascuna unità produttiva 14 giorni dopo che siano risultati positivi gli accertamenti per la presenza dell'IA.
Il trasporto dei suini verso un macello può essere autorizzato qualora siano risultati negativi almeno 60 tamponi nasali/orofaringei prelevati in ciascuna unità produttiva 14 giorni dopo che siano risultati positivi gli accertamenti per la presenza dell'IA.
In caso di risultati non conclusivi o positivi va effettuata ogni eventuale ulteriore indagine atta a escludere l'infezione o la trasmissione dell'IA tra i suini;
e) qualora il veterinario ufficiale abbia il sospetto che altri mammiferi domestici presenti nelle aziende, in particolare quelli di cui è nota la suscettibilità nei confronti dell'infezione da virus dell'IA, sottotipi H5 e H7, siano venuti in contatto con il pollame o con gli altri volatili infetti, devono essere prelevati campioni per gli esami di laboratorio.
8.E. Ripopolamento
8.22. Articolo 49, paragrafo 3, lettere b) e c) — Ripopolamento delle aziende
Quando un veterinario ufficiale effettua un'ispezione in un'azienda commerciale oggetto di ripopolamento, devono essere eseguite le seguenti procedure:
a) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
b) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, soprattutto di quelli che sembrano malati;
c) in ciascuna unità produttiva vanno prelevati i seguenti campioni, invece di quelli standard:
i) almeno 20 campioni ematici, da raccogliere non appena il pollame è stato immesso nell'azienda, salvo si tratti di pulcini di un giorno. Il campionamento può, se del caso, essere effettuato nell'azienda di origine del pollame prima del suo trasporto all'azienda da ripopolare;
ii) campioni del pollame morto o tamponi prelevati dalle relative carcasse, relativi a un massimo di 10 volatili morti a settimana per un periodo di 21 giorni dalla data del ripopolamento;
d) qualora l'azienda sia stata in precedenza infettata da virus HPAI, si devono, se del caso, prelevare anche 20 tamponi tracheali/orofaringei e 20 tamponi cloacali dagli uccelli acquatici (anatre/oche) di ciascuna unità produttiva, entro l'ultima settimana del periodo di 21 giorni dalla data del ripopolamento;
e) qualora l'azienda sia stata in precedenza infettata da virus LPAI, devono essere prelevati 20 tamponi tracheali/orofaringei, 20 tamponi cloacali e 20 campioni ematici in ogni unità produttiva.
8.F. Vac cinazione
8.23. Articolo 56, paragrafo 2), lettera i) — Vaccinazione preventiva del pollame o di altri volatili in cattività Qualora il virus di campo sia noto, sul pollame o sugli altri volatili in cattività vaccinati devono essere eseguiti gli esami di laboratorio di cui al capo IX della
Nel caso di utilizzo di volatili sentinella, essi devono essere presenti in ciascun allevamento vaccinato ed essere sottoposti a esame clinico nonché al test di inibizione dell'emoagglutinazione (HI). A tal fine, almeno ogni 60 giorni devono essere prelevati 20 campioni ematici dai volatili sentinella non vaccinati di ciascuna azienda sottoposta a vaccinazione.
8.24. Allegato IX — Prescrizioni per la movimentazione di pollame o altri volatili in cattività e di prodotti avicoli applicabili in caso di vaccinazione d'emergenza
Per ridurre al minimo il rischio di un'ulteriore diffusione dell'infezione da IA, occorre applicare severe misure di controllo della movimentazione del pollame vivo, degli altri volatili in cattività vivi e delle relative uova.
A tal fine, all'inizio della campagna di vaccinazione d'emergenza occorre applicare le stesse misure di controllo alla movimentazione del pollame vivo, degli altri volatili in cattività vivi e delle loro uova, onde ridurre al minimo il rischio di un'ulteriore diffusione dell'infezione da IA all'interno e all'esterno dalla zona di vaccinazione.
a) Precedentemente alla prima movimentazione di uova da cova e uova da tavola all'interno della zona di vaccinazione e in uscita dalla medesima e successivamente almeno ogni 30 giorni, il veterinario ufficiale deve eseguire le seguenti procedure:
i) ispezione clinica del pollame riproduttore (parent) o del pollame ovaiolo non vaccinato di ogni unità produttiva, compresi una valutazione dell'anamnesi clinica dell'unità produttiva ed esami clinici del pollame, soprattutto di quei capi che sembrano malati. I campioni standard devono essere prelevati dal pollame di ciascuna unità produttiva; oppure
ii) ispezione clinica del pollame riproduttore (parent) o del pollame ovaiolo vaccinato di ogni unità produttiva, compresi una valutazione dell'anamnesi clinica dell'unità produttiva ed esami clinici dei volatili sentinella di questi allevamenti. I campioni standard devono essere prelevati dai volatili sentinella.
b) Per la movimentazione di capi di pollame o altri volatili in cattività vivi vaccinati verso altre aziende oppure per la movimentazione di pollame vivo vaccinato all'interno della zona di vaccinazione e in uscita dalla medesima, il veterinario ufficiale deve eseguire le seguenti procedure:
i) verifica dei registri relativi alla produzione e allo stato sanitario dell'azienda;
ii) ispezione clinica di ogni unità produttiva, compresi una valutazione della sua anamnesi clinica ed esami clinici del pollame o degli altri volatili in cattività, da effettuare non oltre 72 ore prima della partenza concentrandosi in particolare sui volatili sentinella;
iii) qualora i risultati dei controlli, dell'ispezione e degli esami clinici di cui ai punti i) e ii) siano insoddisfacenti, si devono prelevare i campioni standard dagli animali sentinella. Qualora i risultati di cui sopra siano soddisfacenti, occorre prelevare i seguenti campioni:
— pollame o altri volatili in cattività vaccinati: almeno 20 tamponi tracheali/orofaringei, 20 tamponi cloacali e 20 campioni ematici per l'esecuzione di un idoneo saggio DIVA non oltre 72 ore prima della partenza,
— volatili sentinella: 20 tamponi tracheali/orofaringei, 20 tamponi cloacali e 20 campioni ematici da sottoporre a esame sierologico mediante test di inibizione dell'emoagglutinazione prima della partenza.
CAPITOLO V
Test diagnostici virologici e valutazione dei risultati
1. Fino all'avvento e allo sviluppo dei test molecolari, l'isolamento del virus mediante inoculazione nelle uova embrionate di pollo era considerato il test diagnostico dell'IA di gran lunga più sensibile, essenziale per la successiva identificazione e caratterizzazione del virus infettante. Le fasi principali sono descritte nel presente capitolo.
2. Trattamento dei campioni
Per l'invio i tamponi secchi devono essere immersi in un terreno antibiotico idoneo a garantire un'immersione totale.
È possibile aggregare i campioni in pool di cinque, purché si tratti di campioni relativi alla stessa specie, allo stesso ambito temporale e alla stessa unità epidemiologica.
Le carcasse inviate al laboratorio devono essere sottoposte a esame post mortem e si devono prelevare campioni dai seguenti organi: feci o contenuto intestinale, tessuto cerebrale, trachea, polmoni, fegato, milza e altri organi chiaramente interessati. Può essere costituito un pool di questi organi e tessuti, ma è essenziale trattare separatamente il materiale fecale.
I campioni di feci e gli organi devono essere omogeneizzati (in un miscelatore chiuso oppure in un mortaio con pestello e sabbia sterile) in un terreno antibiotico in modo da ottenere una sospensione al 10-20 % p/v.
I tamponi immersi e le sospensioni devono essere lasciati riposare per circa due ore a temperatura ambiente (o a 4 °C se per periodi più lunghi) e successivamente chiarificati mediante centrifugazione (ad esempio a 800-1 000 x g per 10 minuti).
3. Isolamento del virus nelle uova embrionate di pollo
Il liquido sopranatante chiarificato deve essere inoculato, alla dose di 0,1-0,2 ml, nella cavità allantoidea di almeno 4 uova embrionate di pollo di 9-11 giorni. Preferibilmente queste uova devono provenire da un allevamento esente da organismi patogeni specifici (SPF), ma laddove ciò non sia fattibile si possono usare uova di un allevamento in cui sia dimostrata l'assenza di anticorpi contro l'influenza aviaria (sieronegativi).
Le uova inoculate sono mantenute alla temperatura di 37 °C e le si sottopone quotidianamente a speratura. Le uova in cui via via si constata che l'embrione è morto o morente e poi tutte le rimanenti uova dopo sei giorni dall'inoculazione vengono refrigerate a 4 °C e il liquido allantoideo/amniotico esaminato per verificare l'attività emoagglutinante.
Qualora non si rilevi alcuna emoagglutinazione, la procedura sopradescritta deve essere ripetuta usando quale inoculo il liquido allantoideo/amniotico non diluito. Qualora venga rilevata l'emoagglutinazione, si deve escludere, mediante coltura, la presenza di batteri. In presenza di batteri, si possono filtrare i liquidi attraverso un filtro a membrana da 450 nm, aggiungere altri antibiotici e procedere nuovamente, come indicato sopra, alla inoculazione nelle uova embrionate.
Al fine di accelerare la diagnosi alcuni laboratori sono ricorsi a due passaggi con incubazione di 3 giorni ciascuno o a passaggi di 2 e 4 giorni ciascuno, pervenendo a risultati analoghi a quelli ottenuti con due passaggi con incubazione di 6 giorni ciascuno; tuttavia questo dato non è stato ancora valutato appieno.
Sui liquidi risultati positivi occorre effettuare una ricerca per accertare l'assenza di batteri. In presenza di batteri, si possono filtrare i liquidi attraverso un filtro a membrana da 450 nm oppure centrifugarli in modo da eliminare i batteri, per poi inocularli di nuovo nelle uova dopo aver aggiunto ulteriori antibiotici.
4. Diagnosi differenziale
a) Differenziazione preliminare
Data l'importanza di porre in atto con la massima tempestività misure di lotta volte a limitare la diffusione del virus dell'IA, ciascun laboratorio nazionale di riferimento che abbia isolato un virus emoagglutinante deve essere in grado di determinare se si tratta di un virus influenzale A del sottotipo H5 o H7 o del virus della malattia di Newcastle. I liquidi emoagglutinanti devono essere utilizzati nei test di inibizione dell'emoagglutinazione secondo quanto descritto nel capitolo IX. Un test di inibizione positivo, con un titolo entro 2-3 log2 rispetto al controllo positivo, con antisieri policlonali specifici per i sottotipi H5 o H7 dell'influenza A, potrà servire per un'identificazione preliminare sulla cui base istituire misure provvisorie di lotta.
b) Identificazione di conferma
Dal momento che esistono 16 sottotipi di emoagglutinina e 9 sottotipi di neuraminidasi dei virus influenzali con le relative varianti, non è funzionale né economicamente ragionevole che ogni laboratorio nazionale di riferimento detenga antisieri che consentano un'identificazione completa del sottotipo degli isolati influenzali. Tuttavia, ogni laboratorio nazionale di riferimento deve perlomeno:
i) confermare che l'isolato è un virus influenzale A mediante test di immunodiffusione doppia per la ricerca degli antigeni di gruppo;
ii) stabilire se l'isolato è del sottotipo H5 o H7. L'identificazione positiva impone l'applicazione delle misure di lotta contro l'LPAI dei sottotipi H5 e H7;
iii) inviare immediatamente tutti gli isolati HPAI e tutti gli isolati H5 e H7 al laboratorio comunitario di riferimento ai fini della conferma e della caratterizzazione completa, salvo nel caso in cui venga concessa una deroga conformemente alla lettera d).
Inoltre nei laboratori dotati di strutture adeguate è auspicabile:
iv) eseguire un test nei pulcini di sei settimane per determinare l'indice di patogenicità intravenosa. Indici di patogenicità intravenosa superiori a 1,2 indicano la presenza del virus, che impone l'attuazione completa delle misure di lotta contro l'HPAI.
I laboratori nazionali di riferimento devono anche fare in modo di disporre delle competenze e delle attrezzature necessarie per il sequenziamento nucleotidico del gene dell'emoagglutinina, in modo da determinare per ogni virus H5 o H7 LPAI se siano presenti aminoacidi basici multipli a livello del sito di clivaggio della proteina precursore dell'emoagglutinina. Anche se il laboratorio comunitario di riferimento si occuperà prioritariamente della determinazione della patogenicità nell'ambito dei compiti di cui all'allegato VII, punto 2, lettera b), della
c) Ulteriore tipizzazione e caratterizzazione degli isolati
Il laboratorio comunitario di riferimento deve ricevere dai laboratori nazionali di riferimento tutti i virus emoagglutinanti per le ulteriori ricerche antigeniche e genetiche, in modo da pervenire a una maggiore comprensione dell'epidemiologia della/e malattia/e nella Comunità, conformemente alle funzioni e ai compiti che ad esso incombono in forza dell'allegato VII della
Oltre a ciò il laboratorio comunitario di riferimento deve effettuare una tipizzazione antigenica completa di tutti i virus influenzali ricevuti. Per quanto concerne i virus H5 e H7 il cui indice di patogenicità intravenosa non sia superiore a 1,2, deve essere effettuato immediatamente anche il sequenziamento nucleotidico del gene dell'emoagglutinina, in modo da determinare se siano presenti aminoacidi basici multipli a livello del sito di clivaggio della proteina precursore dell'emoagglutinina. Il laboratorio nazionale di riferimento e l'autorità competente nel paese di origine del materiale analizzato devono essere informati dei risultati non appena essi siano disponibili, in modo che possa essere data piena attuazione alle misure di lotta contro l'HPAI.
d) Data la mutevole situazione epidemiologica relativa all'HPAI/LPAI, previo accordo della Commissione e del laboratorio comunitario di riferimento, una deroga può essere concessa ai laboratori che dispongono delle capacità necessarie per una caratterizzazione rapida del virus a inoltrare un subset dei virus dopo l'esame dei dati, e al laboratorio comunitario di riferimento ad operare l'opportuna selezione. Questa deroga può essere concessa solo nel caso in cui il laboratorio nazionale di riferimento sia in grado di produrre rapidamente i dati e di condividerli con il laboratorio comunitario di riferimento.
CAPITOLO VI
Test molecolari e valutazione dei risultati
L'attuale definizione dell'HPAI consente l'identificazione molecolare dei fattori di virulenza, avvalorando in tal modo l'uso delle tecniche molecolari nella diagnosi dell'IA. Si sono di recente registrati sviluppi nell'applicazione di queste tecniche al riconoscimento e alla caratterizzazione del virus dell'IA direttamente a partire da campioni clinici di volatili infetti. Le metodiche RT-PCR tradizionali applicate ai campioni clinici potrebbero consentire, con primer definiti correttamente, un riconoscimento rapido e l'identificazione del sottotipo (perlomeno H5 e H7) oltre a dare un prodotto di amplificazione che potrebbe essere utilizzato per il sequenziamento nucleotidico; la loro applicazione si è inoltre rivelata importante per quanto concerne l'individuazione rapida di focolai successivi, una volta individuata la sede dell'infezione primaria e caratterizzato il virus. La RT-PCR single step in tempo reale con primer/sistemi di saggio fluorogenico (rRT-PCR) consente una diagnosi ancora più rapida e sensibile con riconoscimento dei virus dell'IA e determinazione del sottotipo H5 o H7 nei campioni clinici.
Un problema importante con le tecniche RT-PCR e rRT-PCR risiede nel fatto che finora i diversi laboratori hanno sviluppato sistemi diversi che, pur perfettamente legittimi, non sono stati convalidati né testati con un numero elevato di campioni nei vari laboratori. Il laboratorio comunitario di riferimento e determinati laboratori nazionali di riferimento stanno affrontando questo problema nel quadro di un progetto (AVIFLU) finanziato dalla Comunità, in modo da elaborare protocolli convalidati per la RT-PCR tradizionale e la rRT-PCR che potrebbero essere adottati da altri laboratori di riferimento nazionali. Se i parametri del test, come i cicli e il tempo di passaggio tra una temperatura di reazione e la successiva (velocità di ramping), sono diversi rispetto a quelli raccomandati nei protocolli indicati, prima di poterli utilizzare se ne deve dimostrare l'idoneità secondo quanto previsto dal capitolo I, punto 6, del presente manuale diagnostico.
I protocolli standard applicati dal laboratorio comunitario di riferimento per quanto concerne i test molecolari e la valutazione dei loro risultati sono consultabili nel seguente sito web:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
CAPITOLO VII
Test di patogenicità in vivo e valutazione dei risultati
Per quanto riguarda i virus influenzali A isolati nei volatili, la loro virulenza nei polli deve essere valutata mediante l'indice di patogenicità intravenosa (IVPI). Il relativo test deve essere eseguito nel modo seguente:
a) preparare in soluzione fisiologica isotonica sterile una diluizione 1:10 di liquido allantoideo infetto fresco con un titolo HA > 1/16 (> 24 o > log2 4 se espresso come inverso) proveniente dal più basso livello di diluizione disponibile, preferibilmente dal primo isolamento senza alcuna selezione;
b) iniettare per via endovenosa 0,1 ml del virus diluito in ciascuno dei 10 pulcini di sei settimane esenti da organismi patogeni specifici (SPF) o sieronegativi;
c) esaminare i volatili ogni 24 ore per 10 giorni. Classificare ognuno dei volatili ad ogni osservazione nel modo seguente: 0 = normale; 1 = malato; 2 = gravemente malato; 3 = morto. La classificazione dei volatili malati e gravemente malati si basa su una valutazione clinica soggettiva.
Di solito i volatili «malati» presentano uno dei segni elencati di seguito, mentre quelli «gravemente malati» ne presentano più di uno: quadro respiratorio, depressione, diarrea, cianosi della superficie cutanea non ricoperta di piume o del bargiglio, edema della faccia e/o della testa, segni neurologici. Ai volatili morti deve essere assegnato il punteggio 3 in occasione di ogni osservazione giornaliera successiva alla morte.
Per ragioni di benessere degli animali, i volatili troppo malati per alimentarsi o bere devono essere abbattuti in modo eutanasico e classificati come morti all'osservazione successiva, in quanto destinati a morire entro 24 ore senza intervento.
Questa metodologia è accettabile per le autorità responsabili dell'accreditamento;
d) l'IVPI è il punteggio medio per volatile in rapporto a un'osservazione effettuata su un arco di 10 giorni. Un indice pari a 3,00 significa che tutti i volatili sono morti entro 24 ore, mentre un indice pari a 0,00 indica che nessun volatile ha evidenziato segni clinici durante il periodo di osservazione di 10 giorni.
L'esempio che segue mostra un metodo semplice di registrazione dei risultati e di calcolo degli indici:
|
Segni clinici |
Giorni successivi all'inoculazione |
Punteggio totale |
|||||||||
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
normale |
10 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
12 x 0 = 0 |
|
malato |
0 |
4 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6x1=6 |
|
gravemente malato |
0 |
2 |
2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
6x2=12 |
|
morto |
0 |
2 |
6 |
8 |
10 |
10 |
10 |
10 |
10 |
10 |
76x3=228 |
|
|
|
|
|
|
|
|
|
|
|
|
Totale = 246 |
Note:
10 volatili osservati per 10 giorni = 100 osservazioni
Indice = punteggio medio per volatile per osservazione = 246/100 = 2,46
Qualsiasi virus influenzale A, indipendente dal sottotipo, è considerato un virus HPAI, se l'IVPI è superiore a 1,2.
CAPITOLO VIII
Esami sierologici e valutazione dei risultati
Il metodo raccomandato per dimostrare la presenza del virus influenzale A consiste nel dimostrare la presenza degli antigeni della matrice o della nucleoproteina, che sono comuni a tutti i virus influenzali A.
Vi si può pervenire mediante immunodiffusione doppia, utilizzando preparati di virus concentrati o estratti di membrana corio-allantoidea infetta.
I metodi raccomandati per i test sierologici per la ricerca degli anticorpi al virus dell'IA sono il test di emoagglutinazione (HA) e il test di inibizione dell'emoagglutinazione (HI).
Il capitolo 2.7.12 del Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Manuale dei test diagnostici e dei vaccini per animali terrestri) dell'Ufficio internazionale delle epizoozie (OIE) contiene informazioni dettagliate sulle tecniche di laboratorio e sulla valutazione dei risultati.
I protocolli standard applicati dal laboratorio comunitario di riferimento per quanto concerne i test sierologici e la valutazione dei loro risultati sono consultabili nel seguente sito web:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
CAPITOLO IX
Sistemi di monitoraggio associati alla vaccinazione
1.
Il capo IX, sezioni 2 e 3, della
Scopo della vaccinazione deve essere quello di prevenire l'infezione e la successiva diffusione del virus tra gli allevamenti.
Esistono prove incontestabili che dimostrano che la vaccinazione aumenta la quantità di virus necessaria a infettare i volatili e riduce la quantità di virus escreto. Tuttavia, anche se nei volatili vaccinati non compaiono più i segni clinici della malattia, essi sono in grado di diffondere ancora il virus se sottoposti ad infezione sperimentale (challenge). Di conseguenza, per un certo tempo i virus HPAI, sottotipi H5 e H5, potrebbero circolare in modo latente in un allevamento che presenta livelli subottimali di immunità, analogamente a quanto potrebbe accadere con i virus LPAI in un allevamento non vaccinato. occorre pertanto essere in grado di individuare gli allevamenti vaccinati positivi al virus, infettati dal virus di campo in modo da poter attuare altre misure di lotta, come l'abbattimento coatto (stamping out).
2. Uso dei volatili sentinella per il monitoraggio dell'infezione
A livello di allevamento un metodo semplice consiste nel monitoraggio periodico, in ciascun allevamento vaccinato, dei volatili sentinella non vaccinati; tuttavia questo sistema pone alcuni problemi di gestione, in particolare per quanto riguarda l'individuazione dei volatili sentinella soprattutto nei grandi allevamenti. Si deve garantire il contatto tra i volatili sentinella e quelli vaccinati.
3. Test di laboratorio DIVA per il monitoraggio dell'infezione
In alternativa o in aggiunta a quanto descritto sopra, si può verificare l'esposizione naturale dei volatili vaccinati mediante i test di laboratorio DIVA. Negli ultimi anni sono stati messi a punto vari tipi di test che consentono anche di riconoscere l'infezione naturale dei volatili vaccinati. Un metodo che si è rivelato valido consiste nell'uso di un vaccino contenente un virus con lo stesso sottotipo di emoagglutinina (H), ma una diversa neuraminidasi (N) rispetto al virus di campo predominante. Gli anticorpi anti-N del virus di campo fungono da marker naturali dell'infezione.
Tale sistema è stato utilizzato in Italia a seguito della ricomparsa di un virus LPAI H7N1 nel 2000. A integrazione delle misure di lotta diretta, è stata applicata una strategia DIVA utilizzando un vaccino contenente il virus H7N3 per combattere l'infezione di campo causata dal virus H7N1. I volatili vaccinati e quelli esposti al virus di campo sono stati differenziati mediante un test sierologico volto a individuare gli anticorpi specifici anti-N1. La stessa strategia è stata applicata per la lotta contro la LPAI causata in Italia nel 2002-2003 dal virus H7N3; in tal caso si è utilizzato un vaccino H7N1 e un test sierologico volto specificamente a individuare gli anticorpi anti-N3. In entrambi i casi la vaccinazione accompagnata dall'abbattimento coatto basato su questa strategia DIVA ha consentito l'eradicazione del virus di campo.
Questi sistemi danno luogo a problemi se compare un virus di campo con lo stesso antigene N del virus di campo esistente, ma di un sottotipo H diverso da H5 o H7 oppure se sottotipi con lo stesso antigene N circolano già sul territorio. È noto in particolare che le anatre sono portatrici di più di un sottotipo. È stato necessario anche mettere a punto un test idoneo che consentisse il monitoraggio di routine degli allevamenti per gli anticorpi anti-neuraminidasi.
In Italia è stato messo a punto e utilizzato un test sierologico ad hoc, basato su una prova di immunofluorescenza indiretta, utilizzando come antigene le proteine N prodotte da baculovirus ricombinanti. Un'applicazione più ampia e agevole potrà avvenire con la messa a punto di un test ELISA.
L'uso di vaccini contenenti unicamente HA, come ad esempio i vaccini a vettore ricombinante, consente di utilizzare i tradizionali test AGID o ELISA per la ricerca della nucleoproteina, della proteina non strutturale o delle proteine della matrice, ai fini del rilevamento dell'infezione nei volatili vaccinati.
Per quanto concerne i vaccini inattivati, è stato descritto un test che individua gli anticorpi nei confronti della proteina virale non strutturale, i quali si sviluppano unicamente durante l'infezione naturale. Tale sistema deve essere ancora convalidato sul campo; il limite risiede comunque nel fatto che in un allevamento l'infezione naturale dovuta a qualsiasi virus influenzale, indipendentemente dal sottotipo, porta alla produzione di anticorpi contro la proteina non strutturale.
La messa a punto di metodiche rapide e sensibili per il riconoscimento del virus, soprattutto di quelle automatizzabili, come la RT-PCR in tempo reale, consentirebbe di eseguire facilmente la ricerca periodica e su vasta scala del virus di campo nei volatili vaccinati. Il riconoscimento dell'agente infettante si limita a un breve periodo finestra nella fase acuta dell'infezione e non consente di concludere che l'allevamento non sia stato in precedenza esposto al virus.
Questo è il tipo di esame più adatto da effettuare sugli animali vaccinati prima della loro movimentazione, al fine di dimostrare l'assenza dell'infezione attiva.
Il numero dei campioni da sottoporre a esame in base ai sistemi prescelti deve consentire di escludere che l'allevamento presenti una prevalenza dell'infezione da virus dell'IA superiore al 15 % con livello di confidenza del 95 %.
CAPITOLO X
Strategie di diagnosi dell'IA
Come indicato nell'allegato IV della
Analogamente, è probabile che la necessità di conferma diagnostica della malattia venga ponderata in rapporto alla situazione prevalente, alla gravità del pericolo e al grado di rischio. Le autorità veterinarie devono prendere le loro decisioni sulla base di prove diagnostiche che garantiscano un equilibrio tra un controllo e un'eradicazione rapidi della malattia e le possibili ripercussioni di un'errata diagnosi. Tali valutazioni devono essere effettuate tenendo conto contemporaneamente di una serie di fattori, ma alcune situazioni hanno caratteri di prevedibilità.
|
Situazione della malattia |
Possibile problema |
Criteri diagnostici |
|
Segni non specifici, nessun sospetto ufficiale |
Azienda isolata |
Effettuare il riconoscimento rapido mediante RT-PCR del gene M. Diagnosi differenziale se necessaria. |
|
Sospetto focolaio primario |
Azienda isolata |
Eseguire tutti i test diagnostici, l'isolamento e la caratterizzazione del virus. |
|
Sospetto focolaio primario |
Azienda in una zona ad alta densità di pollame |
Eseguire tutti i test diagnostici, l'isolamento e la caratterizzazione del virus, concentrandosi però sui metodi di riconoscimento e caratterizzazione rapidi, soprattutto la RTPCR e il sequenziamento (1). |
|
Secondo focolaio sospetto e successivi |
Aziende isolate, con correlazione epidemiologica al sospetto focolaio primario |
Concentrarsi sui metodi riconoscimento e caratterizzazione rapidi, soprattutto la RTPCR e il sequenziamento (1). |
|
Secondo focolaio sospetto e successivi |
Aziende in una zona ad alta densità di pollame o con molte correlazioni epidemiologiche |
Basarsi sui metodi di riconoscimento rapido che forniscono quanto prima la prova della presenza di qualsiasi virus dell'IA (1). |
|
Molteplici focolai sospetti oppure diffusione rapida della malattia con sorveglianza |
La diffusione diventa incontrollabile in assenza di interventi rapidi. |
Basarsi sui metodi di riconoscimento rapido che forniscono quanto prima la prova della presenza di qualsiasi virus dell'IA oppure basarsi sui segni clinici (1). |
(1) Per questo occorre effettuare un campionamento completo e i campioni devono essere conservati per una successiva valutazione.
CAPITOLO XI
Diagnosi dell'infezione da virus dell'IA nei suini e negli altri mammiferi
1. L'influenza aviaria nei suini
I virus dell'influenza aviaria infettano facilmente i suini e, anche se nella maggior parte dei casi la replicazione è relativamente limitata, esiste la possibilità che i suini infetti possano trasmettere la malattia al pollame e ad altri animali suscettibili. Finora non si hanno prove raccolte sul campo che i suini infetti trasmettano i virus dell'IA dei sottotipi H5 e H7.
L'esperienza acquisita durante l'epidemia del 2003 nei Paesi Bassi ha mostrato che i suini infettati dal virus H7N7 non mostravano segni clinici riconducibili all'infezione da H7N7. Inoltre a quanto pare finora non sono stati registrati casi di suini malati associati all'epidemia H5N1 in Asia e in altre parti del mondo.
Pertanto non ci si può basare sui segni clinici per determinare se i suini siano infetti, anche se, una volta che il virus si sia adattato all'ospite, si può constatare nei suini un quadro clinico dovuto all'infezione da parte di altri virus influenzali di origine aviaria. La diagnosi delle infezioni da virus dell'IA nei suini è sostanzialmente analoga alla diagnosi nelle specie aviarie; si fonda sull'isolamento del virus, sulle tecniche molecolari e sulla ricerca degli anticorpi specifici mediante i test di inibizione dell'emoagglutinazione. Esistono tuttavia alcune differenze e nessuno dei test ha ricevuto una validazione completa per quanto concerne il loro impiego nella conferma dell'infezione da virus dell'influenza aviaria nei suini.
2. Campioni per l'isolamento del virus
Nei suini le infezioni da virus dell'IA interessano di norma soltanto l'apparato respiratorio e i campioni devono essere tessuti dell'apparato respiratorio e, se del caso, tamponi orofaringei o nasali, prelevati preferibilmente da suini che presentino i segni della malattia. I campioni e i tamponi possono essere trattati ai fini dell'isolamento del virus o del suo riconoscimento molecolare, utilizzando le tecniche precedentemente descritte in relazione ai campioni dei volatili.
Per quanto riguarda le tecniche PCR, si devono tuttavia utilizzare adeguati controlli in modo che l'amplificazione non sia inibita da sostanze presenti nei campioni dei suini.
3. Inoculazione nelle uova e loro incubazione
La prassi per isolare i virus influenzali dei mammiferi nelle uova embrionate di pollo di 9-11 giorni consiste nell'inoculazione in ogni uovo nella cavità amniotica per via allantoidea. Tuttavia, quando i test sono effettuati su suini venuti in contatto con i virus dell'IA e quando il virus ha avuto una scarsa possibilità di adattarsi, è probabile che l'inoculazione nella cavità allantoidea sia sufficiente.
La temperatura di incubazione di norma raccomandata per l'isolamento dei virus dell'influenza A dei mammiferi è 35 °C; tuttavia anche in questo caso va detto che una temperatura di 37 °C non pregiudica l'isolamento del virus, laddove si tratti di virus scarsamente adattati ai suini.
4. Test per la ricerca di anticorpi specifici nei test di inibizione dell'emoagglutinazione (HI)
È probabile che l'isolamento del virus o il riconoscimento molecolare siano le metodiche più sensibili per rilevare l'infezione da virus dell'IA nei suini. Risposte sierologiche sono state tuttavia riscontrate nei suini pur in assenza dell'isolamento o del riconoscimento del virus. I test HI con i sieri di suino impongono alcune modifiche del test utilizzato con i sieri di specie aviarie di cui al capitolo VIII.
Per quanto riguarda i sieri di suino, è nota la loro proprietà di inibizione non specifica nei test HI e pertanto ogni campione di siero deve essere trattato con un enzima distruttore dei recettori (receptor destroying enzyme, RDE) per evitare che ciò avvenga. occorre utilizzare la metodica seguente:
a) a 100 μl di antisiero di suino aggiungere 400 μl RDE (concentrazione d'uso predeterminata) e miscelare accuratamente;
b) incubare a 37 °C per un'ora;
c) successivamente incubare a 56 °C per 30 minuti;
d) refrigerare i campioni a 4 °C per almeno 15 minuti;
e) aggiungere 10 μl di eritrociti di pulcino al 30 % (v/v emazie sedimentate) e miscelare energicamente;
f) incubare a 4 °C per una notte. Altrimenti, se è indispensabile utilizzare i campioni lo stesso giorno, incubare a 37 °C per un'ora e centrifugare a 300 x g per cinque minuti.
Il siero trattato viene poi utilizzato nei test HI secondo quanto descritto per i sieri delle specie aviarie, al punto [...]; la diluizione iniziale è 1:10. Un gruppo di sieri di suini sieronegativi per l'IA deve essere usato per valutare la specificità del test HI per il ceppo virale da utilizzare (utilizzo del ceppo virale isolato dal focolaio per gli esami sierologici, cfr. capitolo VIII). Nell'epidemia verificatasi nei Paesi Bassi nel 2003 il dato delle reazioni non specifiche al test HI ha raggiunto anche il 2,6 % con i sieri di suino raccolti indipendentemente dall'epidemia.
5. Campionamento dei suini
Soprattutto nel caso di aziende che allevano contemporaneamente suini e pollame in capannoni comuni o separati, i suini sono esposti al rischio di contrarre l'infezione da influenza aviaria direttamente o indirettamente attraverso il contatto con il pollame o con i prodotti avicoli. Per escludere l'infezione occorre raccogliere tamponi orofaringei o nasali e campioni ematici seguendo la procedura descritta al capitolo IV, punto 8.21. I campioni devono provenire da suini che presentino i segni clinici della malattia. In assenza di segni clinici, i campioni possono essere comunque raccolti casualmente in ogni parte del capannone. Se il laboratorio è attrezzato, i tamponi devono essere sottoposti ai test molecolari rapidi e/o di isolamento del virus. La RT-PCR deve aver ottenuto un'opportuna convalida e avere una sensibilità perlomeno equivalente al test di isolamento dei virus influenzali A nelle uova.
Da due a quattro settimane dopo l'abbattimento del pollame infettato dall'influenza avaria, occorre raccogliere almeno 60 campioni ematici dai suini, in modo tale che almeno alcuni campioni provengano da gruppi di suini in diretto contatto tra loro. I campioni devono essere sottoposti al test HI utilizzando il virus isolato dal focolaio aviario.
Devono essere sottoposti allo stesso test campioni della fase acuta e di quella convalescente. Per i campioni positivi la conferma può essere ottenuta attraverso il test di neutralizzazione del virus e/o il western blot.
Quando uno di questi campioni risulta positivo, si deve procedere a un'indagine epidemiologica di tutte le aziende suinicole ubicate nella zona di protezione, indipendentemente dal fatto che si tratti di aziende miste o specializzate.
6. Virus dell'IA in mammiferi diversi dai suini
È necessario effettuare indagini anche su altri mammiferi diversi dai suini, compresi i gatti, che sono suscettibili all'IA.
Per quanto riguarda specificamente l'HPAI H5N1, sui gatti devono essere effettuati gli esami elencati di seguito.
Le lesioni patologiche macroscopiche associate a replicazione virale interessano principalmente polmoni e fegato. Di conseguenza i campioni da sottoporre ad accertamenti virologici devono essere preferibilmente prelevati da questi organi di animali morti. Nel caso degli animali vivi, si raccomanda il prelievo di tamponi tracheali/orofaringei per la ricerca del virus. Si possono inoltre prelevare separatamente tamponi fecali.
I campioni ematici da sottoporre ai test HI richiedono un trattamento termico a 56 °C per 30 minuti, mentre si può tralasciare il trattamento RDE.
CAPITOLO XII
Requisiti minimi di sicurezza per il trasporto dei campioni
1. Il trasporto dei campioni, quando è noto che essi contengono materiali patogeni o quando si sospetta che li contengano, è disciplinato da una rigorosa normativa nazionale e internazionale che deve essere rispettata in ogni momento.
Gli isolati virali non sono classificati come campioni diagnostici, ma devono essere confezionati secondo le norme internazionali.
Le istruzioni contenute nel presente capitolo riguardano il trasporto aereo, ma un confezionamento analogo deve essere utilizzato per il trasporto via terra o via mare dei campioni.
2. Imballaggio dei campioni diagnostici per il trasporto
Ai campioni diagnostici trasportati conformemente alle norme IATA viene attribuito il codice UN pertinente, ovvero 2814, 2900 o 3373.
Fino all'arrivo della confezione presso il destinatario, responsabile della merce spedita è lo speditore della merce trasportata e non il vettore.
3. Imballaggio primario
a) I contenitori primari devono essere a tenuta stagna; i tappi a vite devono essere sigillati con parafilm o nastro adesivo oppure devono essere adottate precauzioni analoghe.
b) In caso di più contenitori primari, essi devono essere avvolti singolarmente per evitarne la rottura.
c) Nel determinare il volume dei campioni diagnostici oggetto della spedizione, occorre tener conto del terreno di trasporto virale.
d) I contenitori primari non possono contenere più di 500 ml o 500 g.
Il contenitore primario contiene unicamente il campione diagnostico.
4. Imballaggio secondario
a) Nel contenitore secondario deve essere collocato materiale assorbente in quantità sufficiente ad assorbire l'intero contenuto di tutti i contenitori primari in caso di loro rottura o danneggiamento.
b) L'imballaggio secondario deve soddisfare le prescrizioni IATA previste in materia di confezionamento per i campioni diagnostici, compresa la prova di caduta da un'altezza di 1,2 m (3,9 piedi). È ammesso il confezionamento in base all'istruzione di imballaggio IATA 602 per le sostanze infettive, dato che questa impone prescrizioni più rigorose di quelle previste per il confezionamento dei campioni diagnostici.
c) L'imballaggio dei materiali infettivi deve recare al suo esterno il marchio specifico di confezionamento («UN» all'interno di un cerchio): ad esempio
«UN 4G/CLASS 6.2/99/GB/2450».
d) L'imballaggio secondario deve essere a tenuta stagna. Si devono rispettare le istruzioni di confezionamento accluse all'imballaggio secondario, fornite dal fabbricante del medesimo o da altro soggetto autorizzato.
e) La dimensione minima esterna complessiva dell'imballaggio secondario deve essere di almeno 100 mm (4 pollici).
f) L'imballaggio secondario deve avere un'ampiezza sufficiente per i documenti di trasporto, come ad esempio la lettera di trasporto aereo.
5. Imballaggio esterno
a) L'imballaggio esterno non deve contenere più di 4 l o 4 kg.
b) Se necessario, collocare ghiaccio secco o ghiaccio umido all'esterno dell'imballaggio secondario. Se si utilizza il ghiaccio secco, l'imballaggio deve consentire il rilascio di anidride carbonica e impedire l'aumento di pressione che potrebbe provocare la rottura dell'imballaggio. Se si utilizza ghiaccio umido, l'imballaggio deve essere impermeabile.
Ciascuna confezione e la lettera di trasporto aereo devono recare esattamente la seguente dicitura:
«UN 3373 DIAGNOSTIC SPECIMEN
PACKED IN COMPLIANCE WITH
IATA PACKING INSTRUCTION 650».
c) Un elenco dettagliato del contenuto deve essere posto tra l'imballaggio secondario e l'imballaggio esterno.
d) L'imballaggio esterno deve essere collocato in un sacchetto in plastica sigillato in modo da garantire una protezione contro l'umidità.
e) Non è prescritta la dichiarazione dello speditore per merci pericolose.
CAPITOLO XIII
Invio dei virus e dei campioni al laboratorio comunitario di riferimento
1. I campioni da inviare al laboratorio comunitario di riferimento devono rispettare le raccomandazioni per il trasporto di materiali patogeni pericolosi all'interno della Comunità oltre che i regolamenti e le leggi in vigore nel Regno Unito.
Devono essere rispettate le istruzioni contenute nel presente capitolo.
2. Invio dei virus o degli altri materiali al laboratorio comunitario di riferimento
a) Tutto il materiale deve essere imballato conformemente alle istruzioni contenute nel presente capitolo.
b) L'imballaggio esterno deve recare la seguente dicitura:
«ANIMAL PATHOGEN — PACKAGE ONLY TO BE OPENED AT THE AVIAN VIROLOGY SECTION, VLA, WEYBRIDGE. IMPORTATION AUTHORISED BY LICENCE NUMBER....*......ISSUED UNDER THE IMPORTATION OF ANIMAL PATHOGENS ORDER».
c) Va inserito uno dei seguenti numeri di licenza:
i) per i virus dell'influenza aviaria: «AHZ/2232/2002/5*»;
ii) per i tessuti e altri materiali: «AHZ/2074C/2004/3*».
Dato che di tanto in tanto questi numeri di licenza vengono modificati, i laboratori che inviano i campioni devono, prima della spedizione, verificare che i numeri di licenza utilizzati siano quelli in uso.
d) La confezione deve essere indirizzata a:
Avian Virology
VLA Weybridge,
New Haw, Addlestone,
Surrey KT15 3NB
United Kingdom
e) Il pacco deve essere corredato di una lettera contenente quante più notizie possibili sugli isolati, quali ad esempio quelle relative alla specie e all'età, alla zona/al paese di isolamento del virus, e l'eventuale anamnesi clinica.
f) Le confezioni devono essere inviate per posta aerea o mediante trasporto aereo.
Nel caso di trasporto aereo delle confezioni, il numero della lettera di trasporto aereo deve essere comunicato al laboratorio comunitario di riferimento via fax, per telefono o e-mail prima dell'arrivo dei materiali.
Per il trasporto aereo le confezioni devono recare in modo chiaro la seguente dicitura:
«CARE OF TRANSGLOBAL», in modo da assicurare la rapidità delle operazioni aeroportuali.
Persone da contattare e loro recapiti presso il laboratorio comunitario di riferimento
Ian H. Brown, direttore del laboratorio di riferimento
Telefono diretto: (44-1932) 35 73 39
Fax diretto: (44-1932) 35 72 39
E-mail: i.h.brown@vla.defra.gsi.gov.uk
Ruth Manvell, responsabile del laboratorio di riferimento
Telefono diretto: (44-1932) 35 77 36 o (44-1932) 35 77 08
Fax diretto: (44-1932) 35 78 56
E-mail: r.manvell@vla.defra.gsi.gov.uk.
CAPITOLO XIV
Requisiti minimi di sicurezza applicabili a un laboratorio diagnostico per l'IA
1. I requisiti di sicurezza per i laboratori diagnostici che manipolano i virus dell'IA devono assicurare sia il contenimento dei virus che possono costituire una minaccia per la salute animale sia la protezione degli operatori all'interno del laboratorio (e delle persone all'esterno) contro eventuali rischi zoonotici.
Nella Comunità varie direttive hanno stabilito i requisiti minimi di sicurezza per i laboratori. Inoltre aspetti operativi sono descritti e disciplinati da norme europee (EN). Per quanto riguarda il funzionamento dei laboratori diagnostici esistono ulteriori norme (EN), come le buone pratiche di laboratorio.
2. Direttive comunitarie sui laboratori
Qualora la metodica diagnostica preveda la reazione a catena della polimerasi (PCR) e il clonaggio dei prodotti della PCR in un plasmide batterico per la propagazione, ad esempio ai fini del sequenziamento del DNA, oltre alle due direttive citate si applicano la direttiva comunitaria che segue e alcune norme europee (EN).
3. Oltre alle direttive comunitarie, devono essere rispettate le seguenti norme europee (EN):
EN 12128 Biotecnologie — Laboratori di ricerca, sviluppo e analisi — Livelli di contenimento di laboratori microbiologici, aree di rischio, situazioni e requisiti fisici di sicurezza.
EN 12738: Biotecnologie — Laboratori di ricerca, sviluppo e analisi — Linee guida per il confinamento degli animali inoculati con microrganismi utilizzati a fini sperimentali.
EN 12740: Biotecnologie — Laboratori di ricerca, sviluppo e analisi — Linee guida per il trattamento, l'inattivazione ed il controllo dei rifiuti.
EN 12741: Biotecnologie — Laboratori di ricerca, sviluppo e analisi — Linee guida per le operazioni dei laboratori biotecnologici.
Al funzionamento/alla gestione di un laboratorio si applicano le condizioni di seguito elencate.
4. Prescrizioni per i laboratori (livelli di contenimento da 1 a 4)
Prescrizioni a norma della
|
Misure di contenimento |
Livello di contenimento |
|||
|
|
1 |
2 |
3 |
4 |
|
Laboratori: isolamento |
no |
sì |
sì |
sì |
|
Laboratori separati da porte |
no |
sì |
sì |
sì |
|
Esistenza di una finestra di osservazione o altra alternativa che consenta di vedere le persone all'interno |
facoltativo |
facoltativo |
facoltativo |
sì |
|
Lavabi per il lavaggio delle mani destinati al personale |
sì |
sì |
sì |
sì |
|
Mezzi per la disinfezione delle mani |
facoltativo |
sì |
sì |
sì |
|
Accesso regolamentato |
no |
sì |
sì |
sì |
|
Misure specifiche per il controllo del rilascio degli aerosol |
no |
sì minimizzazione |
sì prevenzione |
sì prevenzione |
|
Simbolo di rischio biologico sulla porta |
no |
sì |
sì |
sì |
|
Docce |
no |
no |
facoltativo |
sì |
|
Irrigazione oculare |
sì |
sì |
sì |
sì |
|
Laboratorio sigillabile in modo da consentire la fumigazione |
no |
no |
sì |
sì |
|
Superfici facili da pulire e resistenti all'acqua, agli acidi, alle sostanze alcaline, ai solventi, ai disinfettanti, agli agenti decontaminanti |
sì (bancone) |
sì (bancone) |
sì (bancone, pavimento) |
sì (bancone, pavimento) |
|
Accesso al laboratorio attraverso camera di compensazione |
no |
no |
facoltativo |
sì |
|
Pressione negativa rispetto alla pressione nell'area circostante |
no |
no |
facoltativo |
sì |
|
Filtraggio HEPA dell'aria immessa nel laboratorio e di quella estratta |
no |
no |
sì (aria in uscita) |
sì |
|
Autoclave |
nel sito |
nell'edificio |
nella zona dei laboratori |
nel laboratorio, a doppia porta |
|
Indumenti protettivi |
indumenti protettivi adeguati |
indumenti protettivi adeguati |
indumenti protettivi adeguati (calzature adeguate facoltative) |
cambio completo di indumenti |
|
Guanti |
no |
facoltativo |
sì |
sì |
|
Controllo efficiente contro possibili vettori (ad esempio roditori e insetti) |
facoltativo |
sì |
sì |
sì |
|
Conservazione degli agenti biologici in condizioni di sicurezza |
sì |
sì |
sì |
sì |
|
Il laboratorio deve contenere le proprie attrezzature |
no |
no |
raccomandato |
sì |
Esistono ulteriori norme europee in materia di gestione e organizzazione dei laboratori.
Vanno rispettate altresì altre norme e raccomandazioni nazionali e internazionali. L'OMS ha pubblicato sul suo sito web il Laboratory Biosafety Manual (Manuale di biosicurezza nei laboratori), terza edizione, accessibile all'indirizzo:
http://www.who.int/csr/resources/publications/biosafety/WHO_CDS_CSR_LYO_2004_11/en/.
5. Contenimento a tutela della salute animale
Le autorità veterinarie degli Stati membri devono predisporre la disciplina in materia di contenimento dei virus dell'influenza aviaria, soprattutto di quelli HPAI, ma anche per tutti i virus dell'IA dei sottotipi H5 e H7. Alcuni orientamenti sono forniti dall'Ufficio internazionale delle epizoozie (OIE) nel capitolo 1.4.5 del Terrestrial Animal Health Code 2005 (Codice sanitario degli animali terrestri) e l'HPAI è considerato un agente patogeno di gruppo 4 in base ai livelli contenimento dell'OIE.
La normativa sulla manipolazione dei virus dell'IA sarà predisposta dalle autorità veterinarie degli Stati membri.
I requisiti minimi di sicurezza applicati dal laboratorio comunitario di riferimento, che coincidono con le norme nazionali del Regno Unito, possono essere consultati al seguente indirizzo Internet:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
6. Contenimento a tutela della salute umana
I laboratori che manipolano i virus dell'IA devono essere in ogni momento consapevoli del fatto che questi costituiscono almeno potenzialmente agenti patogeni per l'uomo e la conduzione del laboratorio deve essere tale da evitare l'infezione di coloro che lavorano nel laboratorio e l'eventuale fuoriuscita di virus a danno delle persone all'esterno.
Per orientamenti su come manipolare i campioni che si sospetta contengano i virus A dell'influenza aviaria, consultare il sito web dell'Organizzazione mondiale della sanità (OMS):
http://www.who.int/csr/disease/avian_influenza/guidelines/handlingspecimens/en/.